Dr David Guex - Dr Jean-Yves Cochet
Janvier 2016 - Magazine DT Study Club (vol 4 - N°1/2016)
Mai 2016 - Dental Tribune
Téléchargez le PDF
L’éternel problème de désinfection du système canalaire est toujours d’actualité. La colonisation de l’endodonte n’est pas sans effets négligeables, tant sur l’origine de pathologies induites connues, que sur les destructions tissulaires immédiates, osseuses et parodontales.
Différentes études montrent la capacité des bactéries à survivre dans un endodonte désinfecté, nettoyé et obturé de façon étanche. Figdor et al.[1] ont démontré qu’Enterococcus faecalis a la capacité de survivre dans des environnements sans nutriments, et à prospérer lorsque la source d’éléments nutritifs est rétablie. Dans une étude ex vivo, Sedgley et al.[2] ont montré qu’Enterococcus faecalis a la capacité de récupérer d'un état de famine prolongée, même séquestrée dans des canaux traités. Inoculée dans les canaux, en l’absence de nutriment, elle reste vitale pendant 12 mois et garde son potentiel pathogène.
Ainsi, les Enterococcus faecalis viables ensevelis au moment du remplissage canalaire, peuvent fournir à long terme un nid pour une infection ultérieure. Dans ce contexte, la multiplicité des instruments existants sur le marché pour activer les solutions d’irrigation, montre que malgré tous nos efforts, nous n’avons pas forcément les résultats escomptés. D’ailleurs, le mot énergie serait peut-être complémentaire à celui de la désinfection, pour devenir une synergie incontournable.
L’hypochlorite chauffée est plus efficace, car l’énergie fournie sous forme de chaleur, potentialise son efficacité. Le fait d’apporter de l’énergie aux solutions d’irrigation va permettre :
- De les véhiculer jusqu’à l’apex.
- De les faire diffuser dans les canaux accessoires.
- De les rendre plus fluides.
- De les rendre plus actives.
Dès qu’un instrument rotatif va à l’apex, il crée deux effets : un bénéfique et le second négatif. L’effet bénéfique est celui de couper une section de la dentine contaminée par les bactéries via les tubuli dentinaires sur plusieurs microns. L’absence de cette dentine contaminée optimisera l’obturation par une meilleure adaptation. L’effet négatif est que toute pénétration instrumentale provoque un passage d’air et une compression de cet air dans un système fermé, par les tissus parodontaux si la dent est pulpée, ou inflammatoires, granulomateux voire kystiques si celle-ci est nécrotique. À ce stade, l’air a totalement pénétré dans le canal, et il va empêcher les irrigants de diffuser jusqu’à la zone apicale ; le bouchon d’air est en place, c’est l’effet physique « Vapor lock ».
Les premiers rapports sur l’effet de piégeage de gaz ou de l’air dans des systèmes fermés ont été réalisés par Deutsch[3] d'un point de vue théorique et Pesse et al.[4] à partir d'une version expérimentale. La solution d’irrigation délivrée à la seringue sans coincer l’aiguille dans le canal ne va pas plus loin que le bout de l’aiguille, en raison de la présence de la colonne d’air[5] dont étonnamment, on redécouvre l’importance aujourd’hui[6]. Depuis lors, de nombreux articles ont décrit l'effet de verrouillage de la vapeur dans les canaux et dans des tubes fermés d’un côté, suggérant qu'en raison de la pression atmosphérique, quand un irrigant est introduit à l’intérieur, la solution est empêchée d'atteindre l’extrémité[7]. Les paramètres physiques affectant l’air emprisonné dans le canal, sont l'angle de contact du liquide d’irrigation et de l'angle des parois du canal[8]. Par exemple un canal avec des parois ayant un angle fermé ne permet pas au liquide d’irrigation d’évacuer l’air emprisonné. Une façon possible d'éliminer les bulles initiales est l'utilisation d'une lime de perméabilité, car les résultats de cette étude[9] ont montré que le maintien de la perméabilité apicale dans des canaux larges, mène à minimiser de manière significative la présence de bulles de gaz dans les tiers moyen et cervical. Mais cette étude parle de canaux larges, alors qu’advient-il des canaux étroits ?
En faisant des tests sur des dents rendues transparentes selon la technique d’Augusto Malentacca, les solutions d’irrigation diffusent très mal vers l’apex. Dès que nous irriguons le canal instrumenté, il reste en permanence une bulle d’air dans la région apicale. Grâce à la lime de perméabilité utilisée entre chaque instrument manuel ou rotatif, nous arrivons à la déplacer, mais il est impossible de l’éliminer[9bis].
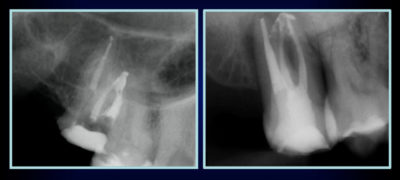
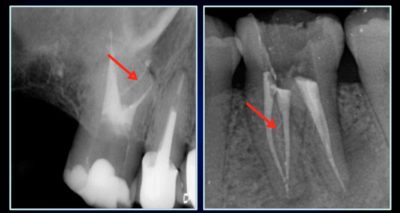
Malheureusement, à l’exclusion de quelques monoradiculées, nous avons à faire à un système canalaire complexe. Cette anatomie endodontique a été mise en évidence par les planche de W. Hess (1925) avec de l’encre de chine[10]. Peters[11] montre que « sur les molaires maxillaires, quelle que soit la technique utilisée, plus de 35 pour cent des surfaces canalaires demeurent non-instrumentées. » Ce problème physique et anatomique, est compliqué par la colonisation bactérienne de ce réseau canalaire labyrinthique.
Dans un premier temps, les bactéries progressent par division plutôt que par déplacement[12]. Ce qui signifie que pour arriver à l’apex, leur nombre doit croître. Et ce que nous trouvons à l’apex, ce sont les bactéries les plus pathogènes[13]. Ainsi, la conjonction entre l’anatomie endodontique et le degré de contamination bactérienne met en évidence qu’il va nous falloir de l’énergie d’irrigation, et pour déstructurer le biofilm bactérien, et pour faire diffuser nos produits dans les tubuli dentinaires. Et plus les bactéries sont en place depuis longtemps, plus elles sont résistantes grâce à un système de protection : le biofilm bactérien. Car bien évidemment, lorsque nous leur laissons du temps, les bactéries vont s’organiser en un biofilm. Un biofilm est constitué en volume d’environ 15 pour cent de bactéries et de 85 pour cent de matrice[14]. La flore endodontique comprend plus de 500 espèces, et ce biofilm devient 1 000 à 2 000 fois plus résistant aux solutions antiseptiques[15]. Par exemple, la concentration nécessaire d’antibiotique pour tuer les souches bactériennes dans un biofilm est 250 fois plus importante que pour des souches bactériennes à croissance planctonique[16]. La conclusion de ces études montre que notre problème majeur est le faible contact des solutions d’irrigation contre les parois dentinaires dans la région apicale, le tout corrélé à deux problèmes bactériens majeurs :
- Les bactéries les plus pathogènes se trouvent dans les derniers millimètres apicaux[13bis].
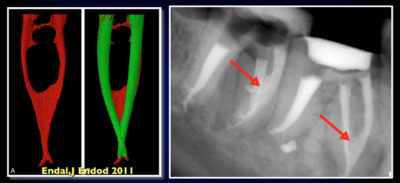
- Les bactéries se situent à la fois le long des parois mais aussi à l’intérieur des tubuli dentinaires, dans des profondeurs variant de 300 à 1 500 µm[17].
Lorsque nous parlons d’énergie transmise aux solutions d’irrigation, nous pouvons penser à l’énergie délivrée par différents systèmes, dont les lasers. Il existe différents lasers, mais actuellement, un faisceau d’études se concentre sur l’utilisation du laser Erbium YAG. En effet, dès 1998, Hirono Takeda a montré qu’en endodontie, le laser le plus efficace est le laser Erbium YAG, pour l’élimination des débris et de la boue dentinaire[18]. Comment pouvons-nous expliquer ces résultats ?
Lorsque nous plongeons la fibre dans la solution contenue dans la chambre pulpaire et que nous appuyons sur la pédale de la machine, la « chambre » génère une série de photons excités à une longueur d’onde précise : 2 940 nm. Les molécules ont intrinsèquement des courbes d’absorption, et il se trouve que cette longueur d’onde de 2 940 nm est maximalement absorbée (= pic d’absorption) par l’eau et l’hydroxy apatite. Lorsque les photons excités à 2 940 nm rencontrent une molécule d’eau, cette molécule d’eau va être sublimée. Le laser Erbium YAG marche par l’implosion de la molécule d’eau. Cette sublimation de la matière s’appelle le plasma (Fig. 1).

Le plasma correspond au quatrième élément constituant l’univers, les 3 autres étant les éléments liquides, gazeux et solides. Notre soleil est un plasma. En fait, le plasma ne sort pas du bout du tip, le plasma est une transformation de la matière par l’énergie photonique. Il y a différents plasmas : plasma d’eau, plasma de dentine, plasma de sang, cela dépend quelle est la matière entrée en contact en premier par les photons. Ce plasma d’eau dans la chambre pulpaire a une température supérieure à 1 500 °C mais sur une durée très courte : 30 micro secondes. C’est l’absorption des photons (excités à 2 940 nm) dans l’eau qui génère de la thermie. Mais c’est le laser Erbium YAG qui génère le moins de thermie par rapport aux autres lasers. En effet, plus la longueur d’onde des photons est haute et moins les photons sont énergétiques.
Récapitulons, nous insérons le tip dans l’eau, l’eau est sublimée en plasma à 1 500 °C, le plasma étant dans l’eau et ayant une température de 1 500 °C, l’eau se transforme en vapeur et crée une bulle : une bulle de vapeur, cette bulle grossit et par conséquence elle augmente la pression liquidienne de la chambre pulpaire. Certaines bulles s’amalgament les unes aux autres pour en former de plus grosses, puis elles partent dans le liquide, et par conséquence dans le canal principal (Fig. 2).
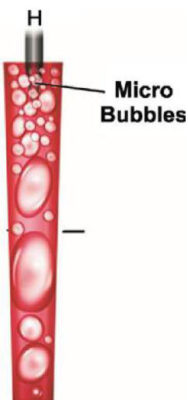
L’activation du laser dans un environnement aqueux génère de larges bulles qui grossissent puis explosent. Cette expansion cause une haute pression dans les fluides : c’est l’effet de cavitation[19].
L’augmentation de la pression intraliquidienne se manifeste par un phénomène visible : l’effet Venturi. L’effet Venturi (du nom du physicien italien Giovanni Battista Venturi) est le nom donné à un phénomène de la dynamique des fluides où les particules gazeuses ou liquides se retrouvent accélérées à cause d'un rétrécissement de leur zone de circulation. Plus le tip est loin de l’entrée canalaire, et plus cette accélération est efficace.
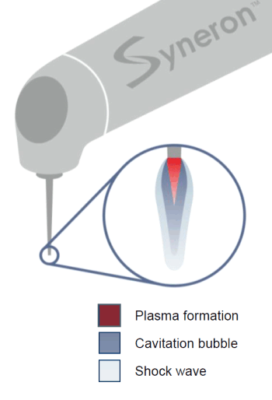
Juste à la sortie de la pointe du tip, l'énergie de l’irradiation de l’Erbium YAG est presque complètement absorbée dans l'eau sur une profondeur de 10 µm. L'eau est immédiatement chauffée à une température d'ébullition et transformée en vapeur en une microseconde. Cette bulle de vapeur commence à se dilater et former un vide en face de la pointe du tip. Comme la bulle de vapeur se dilate jusqu'à ses possibilités d’expansion, on pense que l'émission laser continue passe à travers le vide et évapore la surface de l'eau à la frontière de cette bulle de vapeur[20]-[21]. C’est ce qu’on appelle l’effet de Moses[22]. Mais cette bulle de vapeur ne peut pas s’étendre à l’infini, car la pression extérieure du liquide exerce une force contraire à cette expansion. Quand la bulle est au maximum de son diamètre, la pression extérieure liquidienne reprend le dessus et effondre cette bulle. Lorsque l'irradiation cesse, la bulle de vapeur commence à rétrécir. L’eau entourant la bulle de vapeur s’enfonce fortement à l'intérieur de cette bulle de vapeur qui se décompresse. Au moment de cet effondrement violent, des ondes de pression à vitesse supersonique (ondes de choc) sont générées au début, puis des ondes de pression à la vitesse du son (ondes acoustiques) sont générées secondairement (Fig. 3)[23].
Ces ondes de choc sont aussi appelées blast. Le blast est un terme militaire désignant une explosion provoquant une onde de surpression. Cette onde de choc dans l'air percute la personne et provoque une onde de choc dans son corps (réfraction) ; cette onde de choc interne peut provoquer des dommages internes ayant des effets à retardement. De plus une onde choc générée dans l’eau est plus dévastatrice que dans l’air car l’eau est incompressible.
Pendant l’affaissement des bulles, en raison de l’interaction entre les bulles et leur substrat et ou de l'interaction des bulles sans leur substrat, un jet de liquide à haute vitesse est formé[24]-[25]. Ces ondes de choc et le mouvement rapide de liquide (acoustic streaming) se traduisent par une grande contrainte de cisaillement agissant sur la paroi du canal radiculaire. Cela élimine les débris et joue ainsi un rôle clé dans une efficacité de nettoyage accrue[24bis]. Après la première grande vague de disparition des bulles de vapeur, l'onde de choc change brusquement et modifie largement la pression de l'eau autour de la pointe au laser, ce qui entraîne la nucléation d'un certain nombre de nouvelles bulles de cavitation. Ce phénomène est généralement appelé l’effet rebond[26]-[27].
Conclusion
La formation très rapide du plasma crée l’onde de choc et l’onde de choc est plus violente dans l’eau que dans l’air car l’eau est incompressible. L’onde de choc augmente la pression intracanalaire et favorise ainsi une meilleure élimination des débris dentinaires[24ter]. Ce constat physique est validé par différentes études cliniques in vitro, celle de Tokeda citée précédemment, et par les dernières études des docteurs Stabholtz et Sahar (Figs. 4 et 5)[28]. Mais si ce nettoyage est très efficace dans les canaux principaux et accessoires, qu’en est-il du nettoyage intratubulaire ?


L’effet de cavitation : Gordon et al.[29] ont constaté que l’effet de cavitation permettait de réaliser l’expansion et l’effondrement de l’eau intratubulaire aussi profondément que 1 000 µm ou plus. Mais qu’en est-il de l’effet de ces ondes de choc sur les bactéries ?


Le fait d’aspirer cette eau intratubulaire nous permet d’aspirer les bactéries présentent dans les tubuli dentinaires. La longueur d’onde de 2 940 nm est absorbée dans l’eau du cytoplasme bactérien, cela génère une augmentation de la pression intra bactérienne, provoquant la rupture de la membrane lipidique bactérienne. Cette microimpulsion, induite par l’absorption, a été capable de produire des ondes acoustiques assez fortes, pour perturber et détruire les bactéries intratubulaires (Fig. 6).
Ces résultats sont significatifs puisque les bactéries ont été identifiées à des profondeurs de 1 000 µm (Kouchi et al.[30], et à des profondeurs de 800 µm pour E. faecalis (Fig. 7)).
Application clinique du laser en endodontie
Action sur l’hypochlorite
Nous utilisons l’hypochlorite de sodium pour son action bactéricide. L’avantage de tirer dans l’hypochlorite est multiple :
- L’hypochlorite est désinfectante.
- Les ondes de choc permettent de la faire diffuser.
- La création d’un plasma d’eau génère de l’oxygène singulé et triplé : ce sont des molécules très réactives, cela permet d’hyper oxygéner l’hypochlorite et de la propulser.
- En chauffant l’hypochlorite, nous la rendons plus active. Certaines études montrent que lorsque nous activons au laser Erbium YAG de l’hypochlorite de sodium à 25 °C dans la chambre pulpaire, la température de l’hypochlorite dans le tiers apical est montée à 40 °C après 20 secondes d’activation[37].
Différentes études convergent pour montrer que le laser Erbium YAG est supérieur aux autres techniques classiques pour activer les solutions d’irrigation :
- La dissolution des tissus pulpaires est beaucoup plus rapide[31]-[32].
- Il y a d’avantage de débris dentinaires éliminés, donc un meilleur nettoyage[33].
- Meilleure efficacité pour l’élimination des médications intracanalaires temporaires tels que l’hydroxyde de calcium[34].
- Le laser a une action puissante sur l’activation de l’hypochlorite[35].
- Meilleure élimination des bactéries canalaires et intratubulaires[36].
Conclusion
Longtemps décrié et controversé, le laser prend progressivement sa place en endodontie, et tout particulièrement l’Erbium YAG qui répond aux exigences et aux objectifs d’irrigation, de désinfection de l’endodonte, du réseau canalaire, des isthmes et des tubili dentinaires. L’exacerbation de la dynamique d’irrigation va permettre de véhiculer l’irrigant jusqu’au foramen, en assurant sa désinfection et en répondant aux objectifs de l’endodontie moderne. Ceci va bouleverser nos concepts, de « sur préparation » trop souvent ancrés, et répondre aux critères d’économie tissulaire.
Omnipraticien à Villié-Morgon depuis 1999.
Endodontiste exclusif à Bron depuis 2009.
Diplôme universitaire d’anatomie et dissection crânio-cervico-facial de la faculté de médecine de Paris.
Endodontiste exclusif.
Ancien assistant hospitalo universitaire Paris 7.
Professeur invité à la Nova Southeastern University of Florida, États-Unis.
Bibliographie
1 Figdor D, Davies JK, Sundqvist G. Starvation survival, growth and recovery of Enterococcus faecalis in human serum. Oral Microbiol Immunol 2003;18: 234 –9
2 Sedgley CM, Lennan SL, Appelbe OK. Survival of Enterococcus faecalis in root canals ex vivo. Int Endod J 2005;38:735– 42.
3 Deutsch S. A preliminary study of the fluid mechanics of liquid penetrant testing. J Res Natl Bur Stand 1979;84:287–92.
4 Pesse AV, Warrier GR, Dhir VK. An experimental study of the gas entrapment process in closed-end microchannels. Int J Heat Mass Transf 2005;48:5150–65.
5 Luks S. Practical endodontics. Philadelphie : JB Lippincott, 1974 : 82-85.
6 Tay FR, Gu LS, Schoeffel GJ, Wimmer C, Susin L, Zhang K et al. Effect of vapor lock on root canal debridement by using a sidevented needle for positive-pressure irrigant delivery, J Endod 2010 ; 36 : 745-750.
7 Fazio R, Iacono S. Entrapped gas action for one-dimensional models of capillary dynamics. In: Proceedings of the World Congress on Engineering, July 1–3, 2009, London, vol. II. London: World Congress of Engineering; 2009.
8 Bankoff S, Baiche J. Entrapment of gas in the spreading of a liquid over a rough surface. AIChE J 1958;4:24–6
9/9bis Jorge Vera, DDS, Ana Arias and Monica Romero : Dynamic Movement of Intracanal Gas Bubbles during Cleaning and Shaping Procedures: The Effect of Maintaining Apical Patency on Their Presence in the Middle and Cervical Thirds of Human Root Canals—An In Vivo Study. JOE — Volume 38, Number 2, February 2012
10 Hess W. The Anatomy of the root-canals of the teeth of the permanent dentition. John Bale, Sons & Danielsson, Ltd., 1925 ;21-46
11 Peters OA, Schönenberger K, Laib A. Effects of four Ni-Ti preparation techniques on root canal geometry assessed by micro computed tomography. Int Endod J 2001 ; 34 : 221-230.
12 Hall-Stoodley L, Stoodley P. Biofilm formation and dispersal and the transmission of human pathogens, Trend Microbiol 2005 ; 13 : 7-1.
13/13bis Molven O, Olsen I, Kerekes K. Scanning electron microscopy of bacteria in apical part of root canals in permanent teeth with periapical lesions, Endod Dent Traumatol 1991 ; 7 : 226-229.
14 Costertoon W, Veeh R, Shirtliff M, Pasmore M, Post C, Ehrlich G. The application of biofilm science to the study and control of chronic bacterial infections. J Clin Invest 2003 ; 112 : 1466-1477.
15 Svensater G, Bergenholtz G. Biofilms in endodontic infections. Endod Topics.2004 ; 9 : 27-36.
16 Sedlacek MJ, Walker C. Antibiotic resistance in an in vitro subgingival biofilm model. Oral Microbiol Immunol 2007 ; 22 : 333-339.
17 Love RM, Jenkinson HF. Invasion of dentinal tubules by oral bacteria. Crit Rev Oral Biol Med 2002;13:171–83.
18 Takeda FH, Harashima T, Kimura Y, Matsumoto K. Comparative study about the removal of smear layer by three types of laser devices. J of Clinical Laser. 1998 ; 16 : 117-122.
19 Himeka Matsumoto, Yoshito Yoshimine, Akifumi Akamine, Visualization of Irrigant Flow and Cavitation Inducedby Er:YAG Laser within a Root Canal Model(J Endod 2011;37:839–843.
20 Ith M, Pratisto H, Altermatt HJ, Frenz M, Weber HP. Dynamics of laser-induced channel formation in water and influence of pulse duration on the ablation of biotissue under water with pulsed erbium-laser radiation. Appl Phys B 1994;59:621–9.
21 Shori RK, Walston AA, Stafsudd OM, Fried D, Joseph T, Walsh JT Jr. Quantification and modeling of the dynamic changes in the absorption coefficient of water at l = 2.94 mm. IEEE 2001;7:959–70.
22 van Leeuwen TG, van de Veen MJ, Verdaasdonk RM, Borst C. Noncontact tissue ablation by holmium:YSGG laser pulses in blood. Lasers Surg Med 1991;11:26–34.
23 Flotte TJ, Doukas A. Laser induced pressure effects. SPIE, Laser Tissue Interaction 1992;1646:295–300.
24/24bis/24ter Song WD, Hong MH, Lukyanchuk B, Chong TC. Laser-induced cavitation bubbles for cleaning of solid surfaces. J Appl Phys 2004;95:2952–6.
25 Brujan EA. Cardiovascular cavitation. Med Eng Phys 2009;31:742–51.
26 Himeka Matsumoto, Yoshito Yoshimine, Akifumi Akamine, Visualization of Irrigant Flow and Cavitation Inducedby Er:YAG Laser within a Root Canal Model. J Endod 2011;37:839–843
27 Blanken J,DeMoor RJ, MeireM,Verdaasdonk R (2009) Laser induced explosive vapor and cavitation resulting in effective irrigation of the root canal. Part 1: a visualization study. Lasers Surg Med.
28 Sharonit Sahar-Helft, Aysxe Sena Kabasx Sarp, Adam Stabholtz, Vitaly Gutkin, Idan Redenski, Doron Steinberg. Comparison of Positive-Pressure, Passive Ultrasonic, and Laser-Activated Irrigations on Smear-Layer Removal from the Root Canal Surface. Photomedicine and Laser Surgery Volume 33, Number 3, 2015.
29 Gordon W, Atabakhsh VA, Meza F, Doms A, Nissan R, Rizoiu I, Stevens R: The antimicrobial efficacy of the erbium,chromium:yttrium-scandium-gallium-garnet laser with radial emitting tips on root canal dentin walls infected with Enterococcus faecalis. JADA 138:7:992–1002 (2007).
30 Kouchi Y, Ninomiya J, Yasuda H, Fukui K, Moriyama T, Okamoto H: Location of streptococcus mutans in the dentinal tubules of open infected root canals. J Dent Res 59:2038–2046 (1980).
31 Er:YAG Laser Activation of Sodium Hypochlorite for Root Canal Soft Tissue Dissolution, Katharina Kuhn, Heike Rudolph, Ralph G. Luthardt, Karl Stock, Rolf Diebolder and Raimund Hibst.
32 Mehmet Burak Guneser, Dilara Arslan, Aslihan Usumez. Tissue Dissolution Ability of Sodium Hypochlorite Activated by Photon-initiated Photoacoustic Streaming Technique. J Endod 2015;1–4
33 de Groot SD, Verhaagen B, Versluis M, Wu MK, Wesselink PR, van der Sluis LW (2009) Laser-activated irrigation within root canals: cleaning efficacy and flow visualization. Int Endod J
34 H. Arslan, M. Akcay, I. D. Capar, G. Saygili, T. Gok & H. Ertas.An in vitro comparison of irrigation using photon-initiated photoacoustic streaming, ultrasonic, sonic and needle techniques in removing calcium hydroxide. International Endodontic Journal, Volume 48, Issue 3, pages 246–251, March 2015
35 Macedo RG,Wesselink PR, Zaccheo F, Fanali D, van der Sluis LW. (2010) Reaction rate of NaOCl in contact with bovine dentine: effect of activation, exposure time, concentration and pH. International Endodontic Journal 43, 1108–15.
36 Evaluation of the Bactericidal Effect of Nd:YAG, Er:YAG, Er,Cr:YSGG Laser Radiation, and Antimicrobial Photodynamic Therapy (aPDT) in Experimentally Infected Root Canals. Xiaogang Cheng et al. Lasers in Surgery and Medicine 44:824–831 (2012).
37 Etudes publiées en 2011 par le Pr Tomov. G à la Faculté de Médecine Dentaire de Sofia, Bulgarie.
38 Endal, Shen, Knut, Gao & Haapasalo. A high-resolution Computed Tomographic Study of changes in root canal isthmus area by instrumentation and root filling. J Endod 2011 ; 37 : 223-227.