Dr. David Guex
Novembre 2015 - Dentoscope n°153
Téléchargez le PDF
Aujourd’hui, nous constatons la multiplication d’articles scientifiques décrivant l’activation des solutions d’irrigation par l’emploi d’un laser Erbium Yag. Actuellement les utilisateurs de cette technologie constatent moins de douleurs postopératoires et ils pratiquent moins de chirurgie. En effet, après instrumentation et irrigation classiques, ils notent l’absence de débris canalaires remontés par les techniques conventionnelles. Puis, s’ils utilisent le laser Erbium Yag pour activer les irrigants, alors de nouveaux débris apparaissent dans les solutions. Comment pouvons-nous expliquer ce phénomène ?
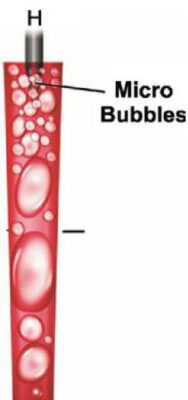
La solution désinfectante utilisée en endodontie est l’hypochlorite de sodium. Elle a une concentration comprise entre 2,5 % et 6 %. Mais c’est avant tout une dilution dans de l’eau. Lorsque nous plongeons la fibre dans la solution contenue dans la cavité pulpaire et que nous appuyons sur la pédale de la machine, la « chambre » génère une série de photons excités à une longueur d’onde précise : 2 940 nm. Les molécules ont intrinsèquement des courbes d’absorption, et il se trouve que cette longueur d’onde de 2 940 nm est maximalement absorbée (pic d’absorption) par l’eau. Lorsque les photons excités à 2 940 nm rencontrent une molécule d’eau, celle-ci va être sublimée. Le laser Erbium Yag provoque l’implosion de la molécule d’eau. Cette sublimation de la matière s’appelle le plasma ; (Fig.1).

Différentes études convergent pour montrer l’efficacité du laser Erbium Yag pour activer les solutions d’irrigation. L’élimination des bactéries canalaires et intra-tubulaires est ainsi majorée.
Le plasma correspond au quatrième élément constituant l’univers, les trois autres éléments étant les éléments liquides, gazeux et solides. Notre soleil est un plasma. En fait, le plasma n’est pas émis par l’extrémité du tips, il est une transformation de la matière par l’énergie photonique. Il y a différents plasmas : d’eau, de dentine, de sang, en fonction de la nature de la matière qui a été exposée aux photons.
Ce plasma d’eau dans la chambre pulpaire a une température supérieure à 1 500°C mais sur une durée très courte de quelques microsecondes. C’est l’absorption des photons (excités à 2 940 nm) dans l’eau qui génère de la thermie. Cependant, le laser Erbium Yag génère moins de thermie que les autres.
En effet, plus la longueur d’onde des photons est haute et moins les photons sont énergétiques. Récapitulons : nous insérons le tips dans l’eau, l’eau est sublimée en plasma à 1 500°C, celui-ci étant dans l’eau à une température de 1 500°C, l’eau se transforme en vapeur et crée une bulle. Cette bulle de vapeur grossit et augmente la pression du liquide de la chambre pulpaire, puis dans le réseau canalaire. Ces bulles s’amalgament les unes aux autres, augmentent de volume, puis explosent, générant une haute pression dans les fluides[1] : c’est la cavitation ; (Fig.2).
Juste à la sortie de la pointe du tips, l’énergie thermique de l’irradiation de l’Erbium Yag est presque complètement absorbée dans l’eau dans une profondeur d’environ 5 μm. L’eau est immédiatement chauffée à une température d’ébullition et transformée en vapeur en une microseconde. Cette bulle de vapeur commence à se dilater et à former un vide en face de la pointe du tips. Comme la bulle de vapeur se dilate jusqu’à ses limites d’extension, on pense que l’émission en continu passe à travers le vide et évapore la surface de l’eau à la frontière de cette bulle de vapeur[2]-[3]. C’est ce qu’on appelle l’effet de Moses[4]. Mais cette bulle de vapeur ne peut pas s’étendre à l’infini, car la pression extérieure du liquide exerce une force contraire à cette expansion. Quand la bulle est au maximum de son volume, la pression extérieure liquidienne reprend le dessus et effondre cette bulle.
Une onde de choc générée dans l’eau est plus dévastatrice que dans l’air, car l’eau est incompressible.
Lorsque l’irradiation cesse, la bulle de vapeur commence à rétrécir. L’eau entourant la bulle de vapeur s’enfonce fortement à l’intérieur de cette bulle qui se décompresse. Au moment de cet effondrement violent, des ondes de pression sont générées, au départ des ondes de pression à vitesse supersonique (onde de choc), et secondairement des ondes de pression à la vitesse du son (ondes acoustiques)[5] ; (Fig.3). Ces ondes de choc sont appelées aussi « Blast ». Le Blast est un terme militaire désignant une explosion provoquant une onde de surpression. Cette onde de choc dans l’air percute la personne et provoque une onde de choc dans son corps (réfraction). Cette dernière peut provoquer des dommages internes ayant des effets à retardement. De plus une onde de choc générée dans l’eau est plus dévastatrice que dans l’air, car l’eau est incompressible. Pendant l’affaissement des bulles, en raison de l’interaction entre les bulles et leur substrat, ou de l’interaction des bulles sans leur substrat, un jet de liquide à haute vitesse est formé[6]-[7]. Ces ondes de choc et le mouvement rapide de liquide (acoustic streaming) se traduisent par une grande contrainte de cisaillement agissant sur la paroi du canal radiculaire, ce qui provoque l’élimination des débris. Ce phénomène joue ainsi un rôle clé dans l’augmentation de l’efficacité de nettoyage[6bis]. Après la première grande vague de disparition des bulles de vapeur, l’onde de choc change brusquement et modifie largement la pression de l’eau autour de la pointe au laser, ce qui entraîne la nucléation d’un certain nombre de nouvelles bulles de cavitation[8]. Ce phénomène est généralement appelé l’effet rebond[9].
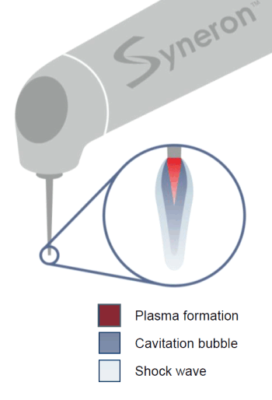
En résumé : la formation très rapide du plasma crée l’onde de choc qui est plus violente dans l’eau que dans l’air car l’eau est incompressible. L’onde de choc augmente la pression intra-canalaire et favorise ainsi une meilleure élimination des débris dentinaires[6]. L’augmentation de la pression intra-liquidienne se manifeste par un phénomène visible : l’effet Venturi. L’effet Venturi (du nom du physicien italien Giovanni Battista Venturi) est un phénomène de la dynamique des fluides où les particules gazeuses ou liquides se retrouvent accélérées à cause d’un rétrécissement de leur zone de circulation. Plus le tips est loin de l’entrée canalaire, et plus cette accélération est efficace.
L’élimination des débris intra-canalaires est validée par différentes études cliniques in vitro. En effet, dès 1998, Hirono Takeda[10] a montré qu’en endodontie, le laser le plus efficace est le laser Erbium Yag pour l’élimination des débris et de la boue dentinaire (smear layer). Ce constat est validé par les dernières études des Dr Stabholtz et Sahar ; (Figs 4 et 5[11]).


Mais si ce nettoyage est très efficace dans les canaux principaux et accessoires, qu’en est-il du nettoyage intra-tubulaire ? Gordon et al.[12] ont constaté que l’effet de cavitation permettait de réaliser l’expansion et l’effondrement de l’eau intra-tubulaire jusqu’à une profondeur de 1 000 μm, voire au-delà. Cet effondrement de l’eau intra-tubulaire est probablement le phénomène le plus important de tous ceux décrits précédemment et dans le nettoyage de l’endodonte. (Fig 6)

Mais qu'en est-il de l'effet de ces ondes de choc sur les bactéries ?
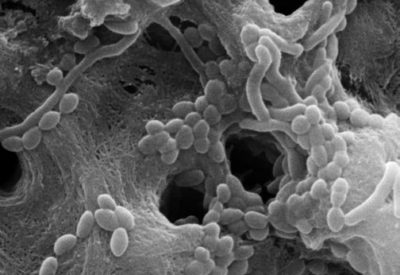
Cette micro-impulsion, induite par l’absorption, a été capable de produire des ondes acoustiques assez fortes pour perturber et détruire les bactéries intra-tubulaires (Fig 7). Ces résultats sont significatifs puisque les bactéries ont été identifiées à des profondeurs de 1 000 μm[13], et à des profondeurs de 800 μm pour E. faecalis. Mais, nous pouvons nous poser une question légitime, la puissance générée par le laser Erbium Yag peut-elle propulser les liquides en dehors du péri-apex ? La réponse est non. Pourquoi ? Dans un premier temps, il ne faut pas mélanger les études in vitro sur dents extraites et les constations cliniques sous microscope opératoire in vivo. En dix ans d’utilisation du laser Erbium Yag, je n’ai jamais vu de liquide remplissant la chambre pulpaire siphonné au-delà du péri-apex par son emploi. La première explication est anatomique : parce que les racines sont entourées par un ligament parodontale et par de l’os, l’endodonte se comporte comme un canal à extrémité fermée ou comme un tube, produisant un effet de verrouillage des gaz contenus dans le liquide[14]-[15]. D’autre part, le ligament parodontal est vascularisé, il existe une pression artérielle dans ce ligament qui s’oppose à la pression liquidienne intra-canalaire. La pression du péri-apex contrebalance celle du laser. Si la pression du liquide exercée par le laser est supérieure à celle du ligament, ou bien si ce dernier est fragilisé car inflammatoire, le premier résultat clinique observé est un saignement instantané. En réaction, nous diminuons l’énergie transmise dans le liquide.
Action sur l'hypochlorite
Nous utilisons l’hypochlorite de sodium pour son action bactéricide. Ses avantages sont multiples :
- L’hypochlorite est désinfectant
- Les ondes de choc permettent de le faire diffuser
- La création d’un plasma d’eau génère de l’oxygène singulé et triplé : ce sont des molécules très réactives, cela permet d’hyper-oxygéner l’hypochlorite et de le propulser.
- En chauffant l’hypochlorite, nous le rendons plus actif. Les études du Pr Tomov montrent que lorsque nous activons avec ce laser de l’hypochlorite de sodium à 25°C dans la chambre pulpaire, la température de l’hypochlorite dans le tiers apical est montée à 40°C après 20 secondes d’activation.
Différentes études convergent pour montrer que ce laser est supérieur aux autres techniques classiques pour activer les solutions d’irrigation. La dissolution des tissus pulpaires est beaucoup plus rapide[16]-[17]. Il y a davantage de débris dentinaires éliminés, l’endodonte est plus propre[18]. Il en va de même pour l’élimination des médications intra-canalaires temporaires telles que l’hydroxyde de calcium[19]. Le laser a une action puissante sur l’activation de l’hypochlorite[20]. L’élimination des bactéries canalaires et intra-tubulaires est majorée[21].
Omnipraticien à Villié-Morgon depuis 1999.
Endodontiste exclusif à Bron depuis 2009.
Diplôme universitaire d’anatomie et dissection crânio-cervico-facial de la faculté de médecine de Paris.
Bibliographie
1 Himeka Matsumoto, Yoshito Yoshimine, Akifumi Akamine, Visualization of Irrigant Flow and Cavitation Inducedby Er:YAG Laser within a Root Canal Model, J Endod 2011;37:839–843.
2 Ith M, Pratisto H, Altermatt HJ, Frenz M, Weber HP. Dynamics of laser-induced channel formation in water and influence of pulse duration on the ablation of biotissue under water with pulsed erbium-laser radiation. Appl Phys B 1994;59:621–9.
3 Shori RK, Walston AA, Stafsudd OM, Fried D, Joseph T, Walsh JT Jr. Quantification and modeling of the dynamic changes in the absorption coefficient of water at l = 2.94 mm. IEEE 2001;7:959–70.
4 Van Leeuwen TG, van de Veen MJ, Verdaasdonk RM, Borst C. Noncontact tissue ablation by holmium:YSGG laser pulses in blood. Lasers Surg Med 1991;11:26–34.
5 Flotte TJ, Doukas A. Laser induced pressure effects. SPIE, Laser Tissue Interaction 1992;1646:295–300.
6/6bis Song WD, Hong MH, Lukyanchuk B, Chong TC. Laser-induced cavitation bubbles for cleaning of solid surfaces. J Appl Phys 2004;95:2952–6.
7 Brujan EA. Cardiovascular cavitation. Med Eng Phys 2009;31:742–51.
8 Blanken J, DeMoor RJ, MeireM, Verdaasdonk R (2009) Laser induced explosive vapor and cavitation resulting in effective irrigation of the root canal. Part 1: A visualization study. Lasers Surg Med.
9 Himeka Matsumoto, Yoshito Yoshimine, Akifumi Akamine, Visualization of Irrigant Flow and Cavitation Inducedby Er:YAG Laser within a Root Canal Model. J Endod 2011;37:839–843.
10 Takeda FH, Harashima T, Kimura Y, Matsumoto K. Comparative study about the removal of smear layer by three types of laser devices. J of Clinical Laser. 1998 ; 16 : 117-122.
11 Sharonit Sahar-Helft, Aysxe Sena Kabasx Sarp, Adam Stabholtz, Vitaly Gutkin, Idan Redenski, Doron Steinberg. Comparison of Positive-Pressure, Passive Ultrasonic, and Laser-Activated Irrigations on Smear-Layer Removal from the Root Canal Surface. Photomedicine and Laser Surgery Volume 33, Number 3, 2015.
12 Gordon W, Atabakhsh VA, Meza F, Doms A, Nissan R, Rizoiu I, Stevens R: The antimicrobial efficacy of the erbium, chromium: yttrium-scandium-gallium-garnet laser with radial emitting tips on root canal dentin walls infected with Enterococcus faecalis. JADA 138:7:992–1002 (2007).
13 Kouchi Y, Ninomiya J, Yasuda H, Fukui K, Moriyama T, Okamoto H: Location of streptococcus mutans in the dentinal tubules of open infected root canals. J Dent Res 59:2038–2046 (1980).
14 Tay FR, Gu LS, Schoeffel GJ, et al. Effect of vapor lock on root canal debridement by using a side-vented needle for positive-pressure irrigant delivery. J Endod 2010;36: 745–50.
15 Senia ES, Marshall JF, Rosen S. The solvent action of sodium hypochlorite on pulptissue of extracted teeth. Oral Surg Oral Med Oral Pathol 1971;31:96–103.
16 Er:YAG Laser Activation of Sodium Hypochlorite for Root Canal Soft Tissue Dissolution, Katharina Kuhn, Heike Rudolph, Ralph G. Luthardt, Karl Stock, Rolf Diebolder and Raimund Hibst.
17 Mehmet Burak Guneser, Dilara Arslan, Aslihan Usumez. Tissue Dissolution Ability of Sodium Hypochlorite Activated by Photon-initiated Photoacoustic Streaming Technique. J Endod 2015;1–4.
18 De Groot SD, Verhaagen B, Versluis M, Wu MK, Wesselink PR, van der Sluis LW (2009) Laser-activated irrigation within root canals: cleaning efficacy and flow visualization. Int Endod J.
19 H. Arslan, M. Akcay, I. D. Capar, G. Saygili, T. Gok & H. Ertas.An in vitro comparison of irrigation using photon-initiated photoacoustic streaming, ultrasonic, sonic and needle techniques in removing calcium hydroxide. International Endodontic Journal, Volume 48, Issue 3, pages 246–251, March 2015.
20 Macedo RG,Wesselink PR, Zaccheo F, Fanali D, van der Sluis LW. (2010) Reaction rate of NaOCl in contact with bovine dentine: effect of activation, exposure time, concentration and pH. International Endodontic Journal 43, 1108–15.
21 Evaluation of the Bactericidal Effect of Nd:YAG, Er:YAG, Er,Cr:YSGG Laser Radiation, and Antimicrobial Photodynamic Therapy (aPDT) in Experimentally Infected Root Canals. Xiaogang Cheng et al. Lasers in Surgery and Medicine 44:824–831 (2012).