Introduction
L’impact inflammatoire d’une dent inconvenablement traitée en endodontie est considérable : AVC, problèmes articulaires, ruptures d’anévrismes, purpura, diabète, céphalées et l’ensemble des organes sont impactés (Ideko et coll 2004, Segura et coll 2015, Cotti et coll 2015, Niazi et coll 2022).
Selon Restrepo et coll 2019, la cicatrisation apicale reste un défi majeur. En effet, leurs calculs montrent un faible taux de cicatrisation des LIPOE (Lésion Inflammatoire Parodontale d’Origine Endodontique) : 53,6 %.
Même si le plateau technique a considérablement évolué (Bartols et coll 2020) et donne de bons résultats (Fleming et coll, 2010), nous avons deux objectifs très importants à atteindre :
- comment nettoyer toute l’anatomie canalaire ?
- comment éliminer la contamination bactérienne et son biofilm proliférant dans l’endodonte ?
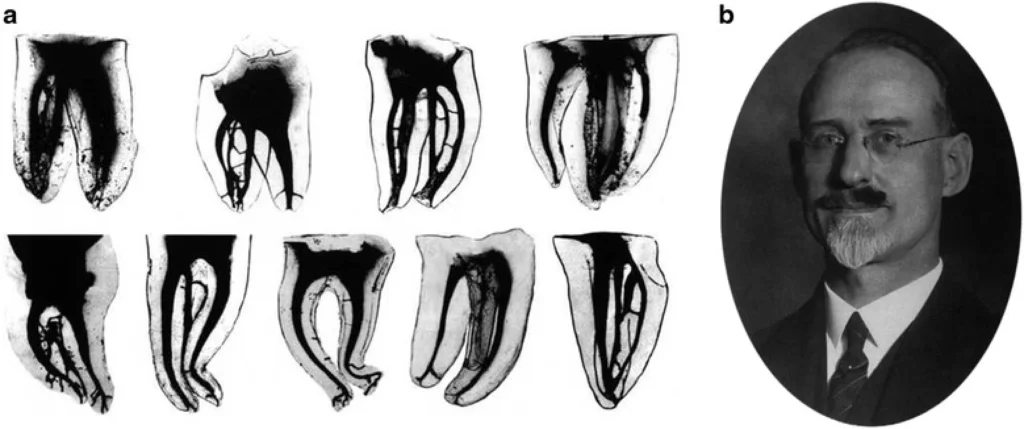
Pour rappel, le Docteur W.Hess a réalisé des travaux fondamentaux en 1917 car il a révélé l’anatomie canalaire en mettant en évidence toute sa complexité (photo 1). Lors de chaque traitement endodontique, le Praticien ou la Praticienne doit garder à l’esprit que les canaux ne sont pas de simples structures tubulaires, mais une arborescence de réseaux infiniment complexes.
C’est ce qui rend difficile l’endodontie et son nettoyage. Le thérapeute doit faire face à cette complexité et il doit nettoyer/décontaminer avec succès tout l’endodonte. Chaque dent est à chaque fois un nouveau défi.
Dès l’instant où les bactéries adhèrent à une surface, elles commencent un processus d’organisation, elles génèrent un biofilm qui est une sorte de gel hydraté auto protecteur. Dans la stratégie thérapeutique, il faut destructrurer les biofilms selon Kornman et coll 1997.
Faisons une digression en comparant la parodontologie et l’endodontie.
En parodontie, la stratégie thérapeutique est de destructurer les biofilms bactériens agressifs pour les exposer aux défenses immunitaires et donc de rétablir l’équilibre biologique du parodonte. Cobb en2006 montre qu’il n’est pas nécessaire d’enlever toute la plaque dentaire. Il faut réduire la population bactérienne selon son concept de la masse bactérienne critique, qui est variable d’un individu à l’autre. En endodontie, la difficulté à éliminer toutes les bactéries est encore plus élevée car il n’y a pas de relais possible par le système immunitaire pour réguler l’homéostasie à l’intérieur du réseau canalaire.
Lorsque les bactéries contaminent les canaux, elles vont progresser par division bactérienne dans l’endodonte, leur nombre va considérablement augmenter, et plus le temps de la contamination augmente et plus la quantité de micro-organismes à détruire sera grande (Lemos et coll 2020).
Lorsque les bactéries ont le temps de s’organiser dans l’endodonte, elles vont générer un biofilm qui rend la flore bactérienne 1000 à 2000 fois plus résistante face aux solutions antiseptiques. Le biofilm bactérien va alors se comporter tel un bouclier de protection (Svensater et coll 2004). Il faudra donc déstabiliser et solubiliser ce biofilm afin d’atteindre ces bactéries (Datey et coll 2019 ; Mirghani 2022).
Cette déstabilisation se fera par la diffusion des irrigants à travers tout le système endodontique.
Classiquement, l’endodontie consiste à ouvrir chaque canal par une instrumentation manuelle et rotative afin de faire circuler librement les irrigants dans l’endodonte. C’est à ce moment que nous créons des débris dentinaires qui vont se mélanger avec le tissu résiduel pulpaire et les contaminants (bactéries – champignons – virus). Cela va former une boue dentinaire appelée smear layer. Pendant l’instrumentation canalaire, cette boue dentinaire va obstruer les entrées des canaux accessoires (voir les obturer) ainsi que les entrées des tubuli canalaires (Haapasalo 2018). Cliniquement, c’est un gros problème.
Peters et coll (2001) ainsi que Bergmans et coll (2001) ont montré que quelques soient les instruments rotatifs utilisés, plus de 35% des surfaces canalaires restent non instrumentées. Il sera nécessaire de nettoyer et désinfecter ces 35 % de surfaces canalaires par des techniques d’activation afin de faire diffuser les irrigants (Zehnder 2006).
En prenant en compte ces données, nous comprenons que l’approche conventionnelle en endodontie peut être problématique pour atteindre le succès thérapeutique. Nous sommes aujourd’hui toujours à la recherche d’un système optimal afin de détruire toutes les bactéries dans ce réseau canalaire complexe, ou bien de les mettre en dormance après l’obturation radiculaire (Tiwari et coll, 2021).
L’objet de cet article est de vous présenter le laser Erbium-Yag comme système d’irrigation canalaire performant.
Apport du laser Erbium-Yag (Er:YAG) en endodontie
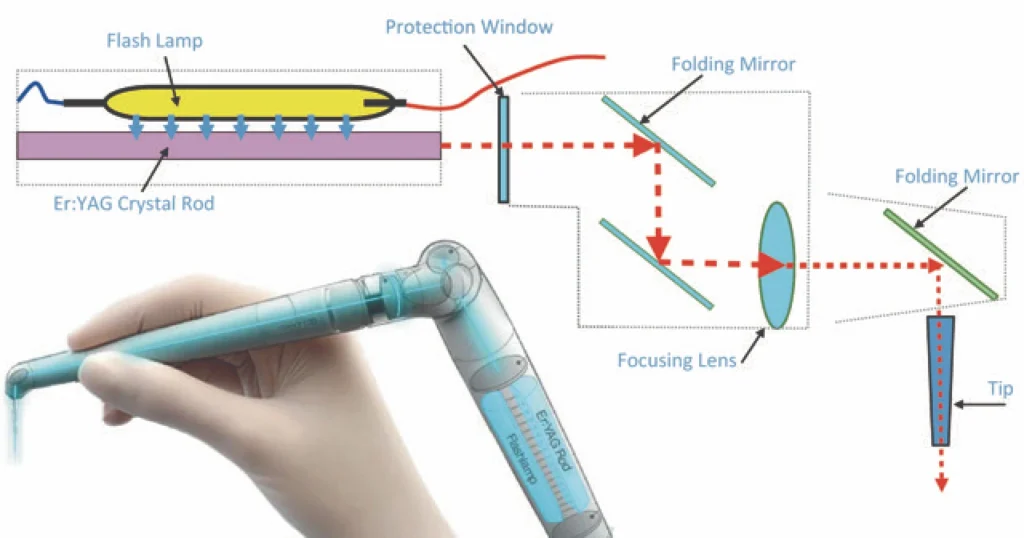
Le laser Er:YAG génère une longueur d’onde de 2940 nm qui est dans la longueur d’onde invisible. Cette longueur d’onde a deux caractéristiques fondamentales en dentisterie : elle est fortement absorbée par l’eau et par l’hydroxy-apatite. Lorsque le faisceau du laser Er:YAG rencontre la molécule d’eau, il se produit un plasma d’eau. Le plasma est une sublimation de la molécule d’eau lors de son explosion. Cliniquement, cette explosion aura un puissant effet dans la déstabilisation des bactéries et de leur biofilm.
Dargidela et coll (2023) démontrent que le traitement combinatoire avec le laser Er:YAG et les techniques d’irrigation conventionnelles avec l’hypochlorite de sodium et/ou QMix (solution contenant EDTA- chlorhexidine-détergeant) sont plus efficaces que les traitements individuels pour éliminer les micro-organismes des canaux radiculaires.
Comment peut-on expliquer de tels résultats ?
En endodontie, nous utilisons deux produits pour la décontamination et le nettoyage :
- l’hypochlorite de sodium (NaOCL) à 5-6 % : c’est la solution de choix car elle permet de solubiliser le tissus pulpaire, le biofilm bactérien, les bactéries, les virus, les champignons (Siquéria et coll 2022).
- l’EDTA à 17% (acide éthylènediaminetétraacétique): c’est l’irrigant de choix afin de dissoudre les boues dentinaires (Álvarez-Sagües, 2021).
Mais ces deux irrigants ne sont pas purs, ils sont dilués dans l’eau : 5% d’hypochlorite de sodium pour 95 % d’eau, et 17% d’EDTA pour 83 % d’eau.
L’eau sera le vecteur d’activation, grâce au laser Er:YAG, permettant aux molécules NaOCL et d’EDTA d’agir sur les tissus cibles.
Quels sont les phénomènes physiques décrits en littérature par l’emploi du laser Er:YAG ?
Plusieurs auteurs montrent que :
- Lorsque le plasma est créé, il engendre un déplacement liquidien par une expansion volumétrique qui est une onde de choc. Nous obtenons un BLAST. Le blast est un terme militaire décrivant un effet de souffle (Karl et coll ). La vitesse de déplacement de l’onde de choc dans l’eau est de 1465 m/s, ce qui est approximativement 4 fois plus rapide que l’onde de choc se déplaçant dans l’air à 366m/s. Nous sommes à Mach 1,07 (Jang et coll, 2023). Cliniquement, cette onde de choc va nous servir à destabiliser les biofilms et à détruire les bactéries.
- Le plasma d’eau généré dans la chambre pulpaire a une température de 1500°C sur une durée de quelques micro-secondes. Cette très grande élévation de température n’est pas dangereuse en clinique. En effet, Sahar et coll, 2023 ont mesuré la température pendant une irrigation en continue durant un acte endodontique. Leur étude montre une augmentation de la température liquidienne de 1,89° ± 1.42 ◦C dans la région apicale alors que dans la région coronaire, l’élévation de la température est plus faible : variation 0.56 ± 0.66 ◦C, ainsi que dans le tiers moyen de la racine : variation 0.71 ± 0.80 ◦C.
- L’eau au contact du plasma va se transformer en vapeur et créer des bulles, qui vont grossir et augmenter la pression du liquide de la chambre pulpaire, cette pression va se propager dans le réseau canalaire. Ces bulles s’assemblent les unes aux autres, augmentent de volume puis explosent en générant une haute pression dans les fluides : c’est la cavitation décrite par Song et coll 2004 et Blanken et coll 2009.
- L’effet de cavitation ainsi produit, correspond à une micro impulsion. Elle est capable de produire des ondes acoustiques assez fortes pour perturber et tuer les bactéries intra canalaires. Cliniquement, Gordon et coll (2007) ont démontré que l’expansion puis l’effondrement de l’eau intra tubulaire pouvait atteindre 1 mm et plus en profondeur dans la paroi canalaire. Les bactéries profondément enfouies sont donc atteintes.
- Lorsque l’irradiation s’arrête, la bulle de vapeur commence à rétrécir. L’eau entourant la bulle de vapeur s’enfonce fortement à l’intérieur du vide de vapeur en décompression. Au moment de cette décompression violente, des ondes de pression à vitesse supersonique (ondes de chocs) sont générées au début puis à la vitesse du son (ondes acoustiques) plus tard (Flotte et coll, 1992).
- Ces ondes de chocs et le mouvement rapide de liquide se traduisent par une grande contrainte de cisaillement agissant sur la paroi du canal radiculaire, ce phénomène provoque l’élimination des débris. Ces contraintes de cisaillement jouent ainsi un rôle important dans l’augmentation de l’efficacité de la décontamination canalaire (De Moor et coll, 2009).
- Cliniquement, l’hypochlorite de sodium se déplace très rapidement dans le canal. Le NaOCL à 5% a été mesurée à une vitesse de 2,353 m/s dans le tiers apical, et plus la concentration de l’hypochlorite de sodium diminue et plus sa vitesse augmente : NaOCL à 2,5% = 3,685 m/s et NaOCL à 1% = 3,868 m/s selon Cai et coll (2022).
- La mesure des pressions internes dans les canaux est difficile à évaluer car elle dépend de plusieurs facteurs : angle du tips (photo 2) par rapport à la surface liquidienne, volume de la chambre pulpaire, diamètre des canaux, vitesse de renouvèlement de l’irrigant etc… Cependant le pic de pression est d’environ 7kPa (Jang et coll, 2023). Pour vous donner une idée, 7 KPa correspondent à la pression nécessaire pour briser des vitres selon Bodurtha et coll (1984). Cliniquement les ondes de chocs peuvent être ressenties jusque dans le crampon à digue. Ces ondes de choc vont nous être utiles car Il a été prouvé que les antiseptiques sont plus efficaces sur les biofilms perturbés par des ondes de choc. (Anwar et coll 1992 ; Marsh, 2004).
- Les ondes de choc vont amplifier l’effet chimique de l’hypochlorite de sodium. Macedo et coll (2010) montrent que le laser Er:YAG va libérer un taux de chlorine plus important que les autres techniques conventionnelles. Les causes d’une telle différence ne sont pas encore complètement comprises.
- Selon Sabbane et coll 2022, le meilleur effet antibactérien a été obtenu dans le groupe traité avec le faisceau laser Er:YAG avec EDTA puis avec un rinçage final avec NaOCl. Cet article modifie la perception de l’importance du NAOCL en endodontie et met en évidence l’importance de l’utilisation de l’EDTA dans notre exercice.
La suite devient encore plus intéressante.
L’amplification des pressions liquidiennes est plus prononcée dans les petits diamètres canalaires (< 3 mm). Les mesures effectuées avec une caméra à grande vitesse montrent que les périodes d’oscillation des bulles de cavitation dépendent fortement de l’énergie de l’impulsion laser et du diamètre du canal, par opposition à la longueur du canal et à la profondeur de la pointe de la fibre dans la chambre pulpaire, qui n’ont qu’une influence mineure sur la période d’oscillation des bulles (LukačN et coll, 2018). Avant l’arrivée du laser Er:YAG, les alésages de fortes conicités ont toujours eu pour but de réduire la tension superficielle des irrigants afin de mieux les faire diffuser à l’apex. Concrètement, cet article nous incite à diminuer le diamètre d’alésage des canaux afin d’avoir une approche mini invasive.
A cet égard, l’étude de Wen et coll (2021) va elle aussi à l’encontre des préceptes d’alésage classiques enseignés en endodontie. Ils montrent que les canaux radiculaires alésés à 25/02 présentaient un pourcentage de bactéries mortes significativement plus élevé que les canaux radiculaires alésés à 25/06 après l’activation par le laser Er:YAG. Ces résultats indiquent que l’élargissement de la conicité des canaux radiculaires n’a eu aucun effet positif sur l’élimination des biofilms lors de l’activation de NaOCl à 2%.
Cliniquement, le laser Er:YAG est plus efficace dans les canaux moins alésés. Cette étude est une excellente nouvelle car nous pouvons nous permettre de conserver d’avantage la structure dentinaire intra canalaire. Nous fragilisons moins les racines. Nous utilisons moins d’instruments rotatifs car nous voulons ouvrir le canal à minima. En utilisant moins d’instruments, le risque de fracture instrumentale devient plus réduit.
Au vu des importants phénomènes physiques générés dans les irrigants, Arslan et coll (2018) ont testé in vitro les extrusions de liquides et de débris lors des préparations instrumentales et lors de l’activation des irrigants. Ils notent que tous les systèmes de limes et d’irrigation extrudaient les débris au niveau apical. L’activation des irrigants par le laser Er:YAG était associée à une quantité significativement plus importante de débris d’extrusion dans les canaux courbes par rapport à l’absence d’activation.
Cliniquement, nous pourrions penser que le laser erbium YAG provoque d’avantage d’extrusions avec des emphysèmes associés, mais il n’en est rien. L’explication est simple. Les racines sont soient entourées par un ligament parodontal et d’os soient par une LIPOE. L’ensemble des études IN VITRO n’ont pas reproduit un système apical fermé.
Tay et coll, 2010, démontrent que les racines in vivo se comportent tel un système clos, et c’est un vrai problème en clinique.
Un canal clos est beaucoup plus difficile à nettoyer et à obturer car il y a des lois physiques qui sont installées dans le canal : la pression atmosphérique générée par l’air et la poussée d’Archimède générée par les liquides.
Lors de la mise en forme canalaire, l’air est rentré dans le canal et il reste emprisonné. Le système canalaire se comporte comme un canal à extrémité fermée ou comme un tube, produisant un bouchon d’air (Luks et coll 1974, Tay et coll 2009). Ce bouchon d’air entrave l’irrigant d’atteindre le tiers apical (Tays et coll 2010, Senia et coll 1971). Et si les irrigants ne peuvent pas aller à l’apex, ce dernier ne sera ni nettoyé ni décontaminé. Cela peut être une explication sur le faible taux de cicatrisation des LIPOE : 53,6% cité plus haut par Restrepo et coll 2019.
Les ondes photo acoustiques permettent de disloquer ces bouchons d’air emprisonnés dans les canaux (Meire et coll 2024).
Concernant la poussée d’Archimède, les liquides présents dans le système canalaire s’opposent à leurs propres renouvèlements, et il est nécessaire d’avoir une énergie suffisante pour renouveler la totalité des irrigants. En effet, les irrigants perdent rapidement leur efficacité parce qu’ils sont activés.
Concernant les reprises de traitements endodontiques : Yang et coll 2021 ainsi que Petricevic et coll 2022 ont testé l’activation des irrigants sur la remontée de débris et matériaux. Ils ont constaté que quelque soit la méthode d’activation des irrigants utilisée, tous les groupes présentaient des matériaux d’obturation radiculaire résiduels dans les canaux radiculaires après retraitement mécanique. L’utilisation supplémentaire des ondes photo acoustiques a permis d’éliminer un volume d’obturation radiculaire significativement plus élevé que les autres techniques d’activation.
Afin de d’illustrer les propriétés du laser Er:YAG adapté en endodontie, j’ai réalisé une expérience permettant de visualiser les effets photo-acoustiques dans la complexité du réseau canalaire.
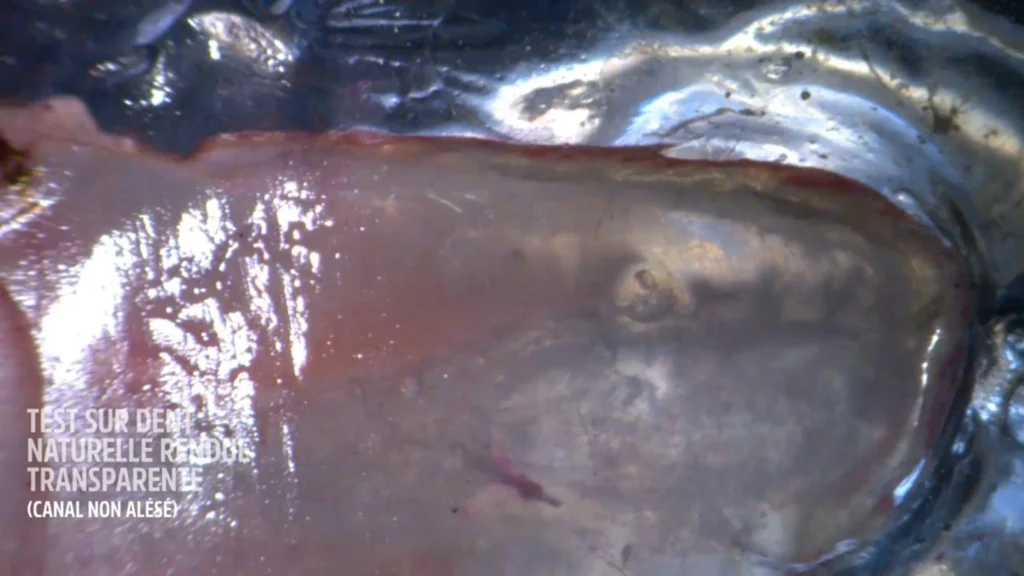
J’ai réalisé une dent transparente à partir d’une pré molaire naturelle selon la technique du Docteur Malentacca.
L’endodonte a été coloré par de la fuscine afin de révéler la complexité canalaire. Le canal est resté vierge de tout alésage manuel ou rotatif. Le péri apex a été rendu hermétique en le scellant avec de la colle cyano-acrylate. Le but était de recréer le poids de la colonne d’eau ou d’air, et d’avoir une résistance des fluides grâce à la poussée d’Archimède.
Il faut très exactement une minute 20 secondes pour faire totalement diffuser l’hypochlorite de sodium dans tous les méandres endodontiques. L’énergie utilisée a été d’1 watt.
La vidéo montre que ce n’est pas l’irrigant qui va à l’apex, mais c’est la fuchsine qui est aspirée par la dynamique des fluides précédemment citée. Nous avons bel et bien une ASPIRATION des fluides intra tubulaires.
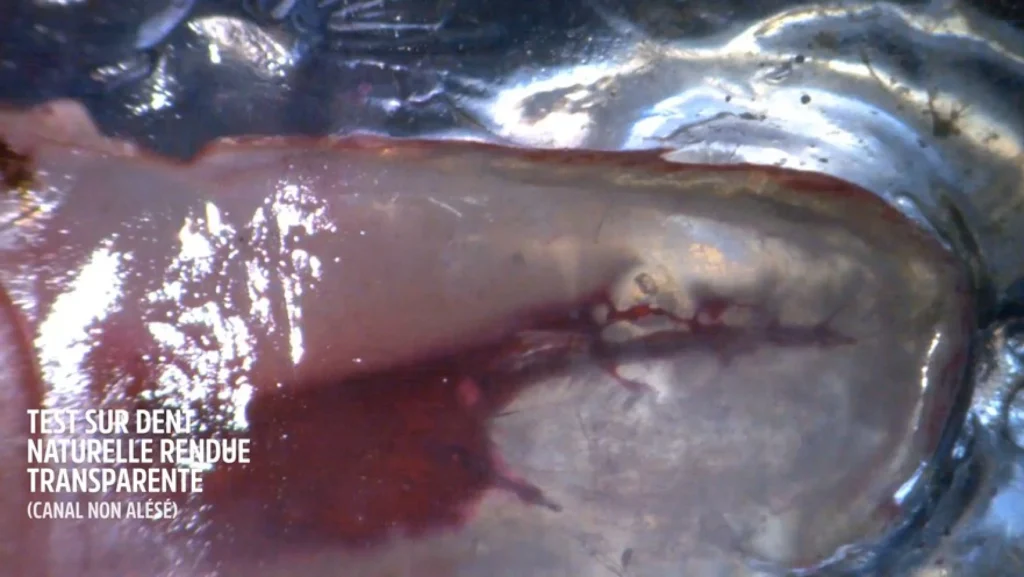
Avant utilisation laser erbium yag : temps 0 s.
Pour passer de la théorie à la pratique et vous montrer qu’on obtient des résultats thérapeutiques performants, vous trouverez ci-dessous deux exemples de cas cliniques didactiques.
Cas cliniques
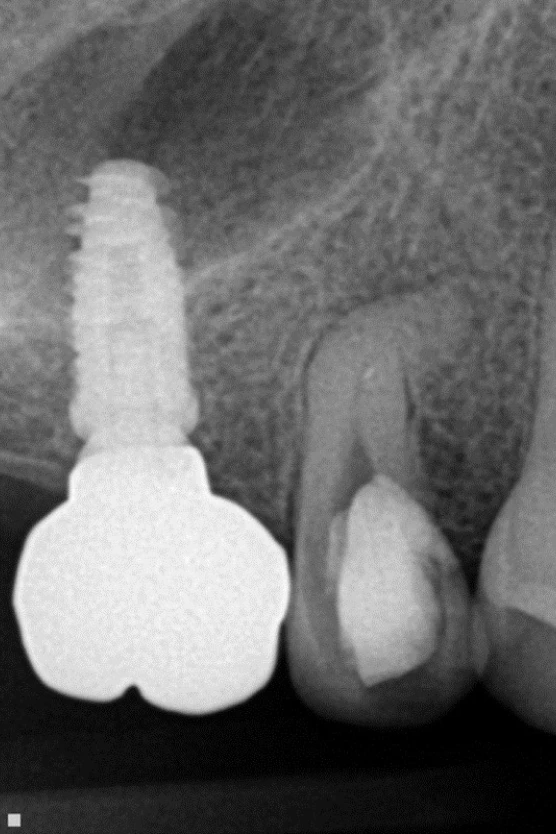
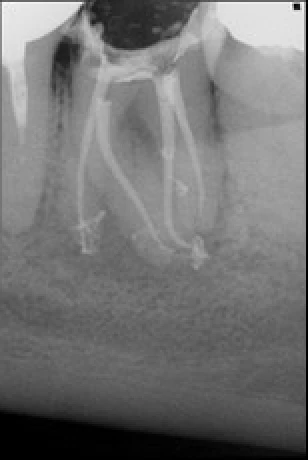
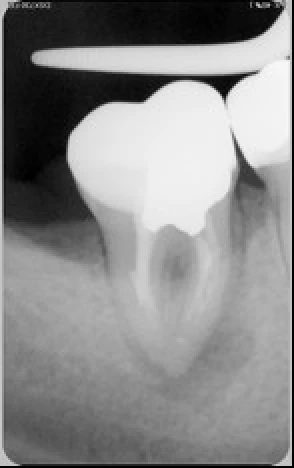
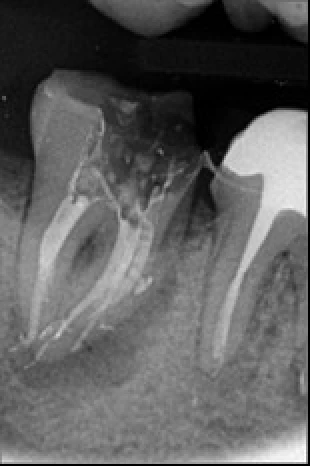
Exemple d’une 15 où la configuration de la racine a rendu impossible tout alésage du tiers apical. Seul le laser erbium yag a pu nettoyer et désinfecter le complexe endodontique.
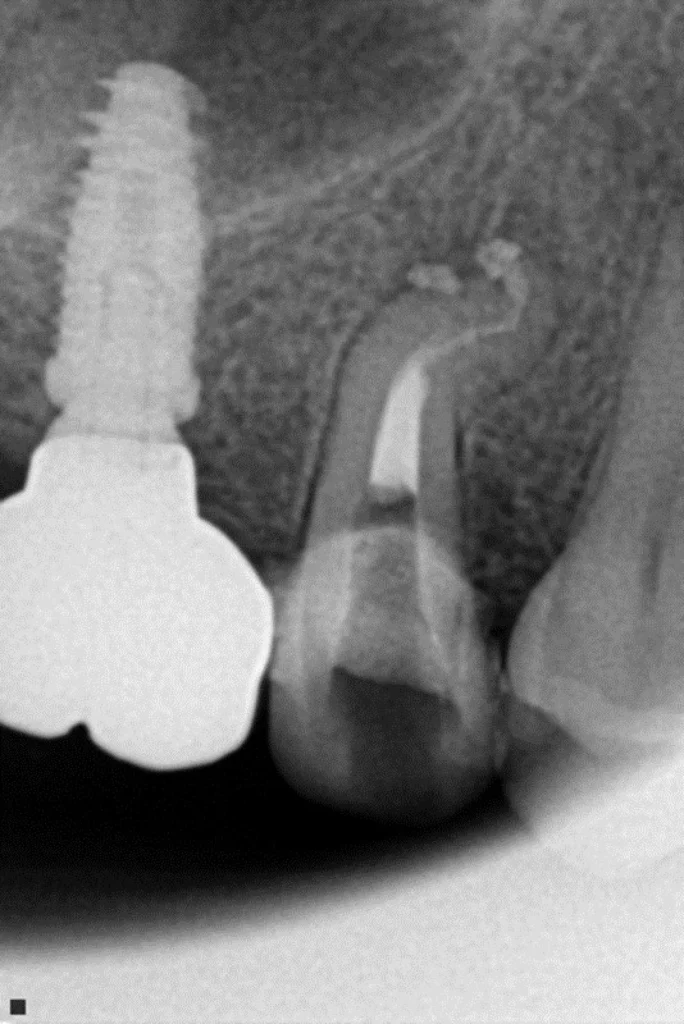
Exemple d’une 37 nécrotique : l’obturation canalaire met en évidence la complexité anatomique de son endodonte. L’activation des solutions d’irrigation par la laser erbium yag a empêché l’obturation des canaux accessoires par la smear layer générée par l’alésage, les canaux accessoires ont pu être nettoyés et désinfectés, nous avons réalisé un alésage de faible conicité à 25/04.
Pour être pratique et didactique, je vous propose la séquence clinique suivante qui vous permettra d’obtenir les résultats présentés dans l’article.
Séquence clinique pour un retraitement canalaire : anesthésie / reconstitution à 4 parois de la chambre pulpaire / mise en place de la digue / rendre étanche la digue aux irrigants pour éviter leurs fuites dans la bouche.
Pendant la phase de désobturation, il est nécessaire d’éliminer les matériaux d’obturation canalaire.
A chaque fois qu’un instrument manuel ou rotatif a progressé en direction apicale, il faut que l’Assistante injecte lentement dans la chambre pulpaire une solution d’EDTA, cette solution est activée pendant 20 secondes environ, il faut utiliser une énergie d’ 1 watt (20 Hz-50 mJ). L’activation se fait sous aide optique afin de vérifier la remontée des débris, il faut balayer le tips au-dessus des entrées canalaires. Dès que la solution devient claire, l’alésage et la mise en forme canalaire se poursuivent jusqu’à atteindre la longueur de travail (LT).
Lorsque les canaux sont alésés à 20/04, il faut activer 1 ml d’hypochlorite, puis 1 ml d’EDTA à 1 watt. L’alésage se poursuit jusqu’à obtenir une buttée apicale pour le maître cône de gutta.
Il est très important d’activer le NaOCL et l’EDTA après chaque passage instrumental. Tant que les irrigants remontent troublés par les débris, il faut renouveler l’irrigation et l’activer.
La dernière irrigation est faite lorsque les irrigants remontent clairs de l’apex. Les canaux peuvent alors être séchés, puis obturés.
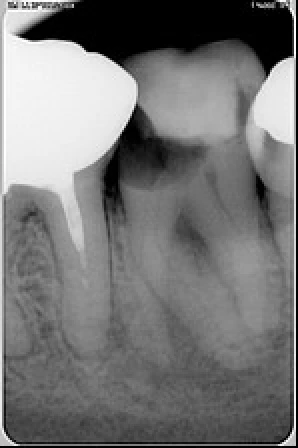
Exemple d’un retraitement canalaire d’une 47 : la LIPOE laisse suggérer une fissure de la racine mésiale. Il n’en était rien. C’est la multitude de canaux accessoires non nettoyés, non désinfectés et non obturés qui ont engendrés cette LIPOE.
Pour être parfaitement transparent sur le sujet, j’ai réalisé une étude statistique sur mon activité clinique en endodontie qui démontre la pertinence et l’efficacité de ce protocole opératoire.
Etude statistique
Dès que j’ai utilisé le laser Er:YAG en endodontie, j’ai eu le sentiment que je faisais moins de chirurgies endodontiques.
Pour illustrer tous les propos cités en début d’article, je voudrais vous proposer une étude statistique sur mon activité clinique.
De 2005 à 2022, j’ai effectué 13939 traitements endodontiques, majoritairement des retraitements. J’ai calculé mon taux d’échec en fonction des chirurgies endodontiques réalisées sur mes traitements endodontiques.
Sur 679 chirurgies endodontiques réalisées sur cette période de 17 ans :
- 373 chirurgies ont été réalisées après mes retraitements endodontiques, en raison de douleurs persistantes, d’absence de cicatrisation des LIPOE, persistance de fistules etc …
- 185 chirurgies sont corrélées à une chirurgie endodontique de première intention sans reprise de traitement endodontique. La raison première était la préservation d’éléments prothétiques.
- 121 chirurgies ont été volontairement programmées à la suite de mes retraitements endodontiques. Cette chirurgie complémentaire devait permettre de résoudre des problèmes que le traitement endodontique initial ne pouvait pas solutionner seul. Exemple : résorption interne ou externe, élimination de ciments canalaires enkystés, apex dilacérés, suspicion de fissures apicales etc …
Calcul :
13939 – 185 – 121 = 13632 cas endodontiques représentatifs.
Pour 13632 traitements endodontiques réalisés, 373 chirurgies endodontiques correspondent à un taux d’échec de 2,73 %.
Cependant le taux d’échec calculé n’est pas exact car il existe des biais :
- des patients qui ne reviennent pas pour les contrôles radiographiques malgré les relances téléphoniques.
- des patients qui se font extraire leurs dents retraitées sans en informer le cabinet.
- des patients qui déménagent.
- des lésions persistantes asymptomatiques.
- amélioration du plateau technique par l’emploi de nouvelles techniques efficientes combinées avec l’utilisation du laser erbium YAG.
- etc
Mon taux d’échec est forcément plus élevé. Ces chiffres ne sont que le reflet de mon activité, cela vaut ce que cela vaut, mais il est fort probable que le laser Er:YAG potentialise les techniques conventionnelles.
Cliniquement, dès 2005, j’ai remarqué une amélioration de mes résultats par l’utilisation du laser erbium yag en endodontie. D’autre part, ce constat est partagé par les nouveaux utilisateurs. Ils notent eux aussi des avancées : une amélioration du nettoyage canalaire par une plus grande remontée de débris, ils ont d’avantage de radiographies montrant des canaux accessoires obturés, ils obtiennent plus de cicatrisations.
Conclusion
Les techniques endodontiques conventionnelles continuent d’être reconnues comme le traitement de référence. Je rejoins complètement l’étude d’Anagnostaki et coll (2020). Ils estiment que la variabilité des taux d’échec signalés a conduit à la nécessité de recourir à des alternatives complémentaires.
Dans ce contexte, l’utilisation des lasers a été minutieusement étudiée par ces auteurs. Leur article fait une revue de littérature systématique visant à explorer les preuves de la valeur clinique des technologies dentaires laser assistées. L’article révèle que presque toutes les études présentaient une amélioration statistiquement significative des résultats du traitement endodontique assisté par laser Er:YAG.
Compte tenu de tous les effets physiques, chimiques, photo acoustiques décrits dans cet article, le laser Er:YAG semble être un outil non conventionnel qui peut bouleverser les protocoles et les résultats de l’endodontie conventionnelle.
La rotation continue a permis de moderniser l’endodontie traditionnelle, elle a changé nos habitudes par son efficacité. N’en doutons pas, le laser Er:YAG sera lui aussi un vecteur de modernisation.
Pour ma part, j’estime que pour faire face aux deux défis que sont la destructuration des biofilms et le nettoyage de la complexité du réseau canalaire, le laser Er:YAG est un outil très efficace et indispensable dans ma pratique quotidienne.
Bibliographie
- Álvarez-Sagües Alejandro, Nerea Herce, Ulises Amador, Francisco Llinares-Pinel, Estanislao Nistal-Villan, Jesús Presa, Laura Álvarez, and Magdalena Azabal. Efficacy of EDTA and HEDP Chelators in the Removal of Mature Biofilm of Enterococcus faecalis by PUI and XPF File Activation. Dent. J. 2021, 9, 41. https://doi.org/10.3390/dj9040041.
- Anagnostaki Eugenia, Valina Mylona, Steven Parker, Edward Lynch and Martin Grootveld. Systematic Review on the Role of Lasers in Endodontic Therapy: Valuable Adjunct Treatment? Dentistry Journal. 2020, 8, 63.
- Anwar, H., Strap, J. L., and Costerton, W. (1992). Establishment of aging biofilms: possible mechanism of bacterial resistance to antimicrobial therapy. Antimicrob. Agents Chemother. 36, 1347–1351. doi: 10.1128/AAC.36.7.1347
- Arslan, D.; Kustarci, A. Efficacy of Photon-Initiated Photoacoustic Streaming on Apically Extruded Debris with Different Preparation Systems in Curved Canals. Int. Endod. J. 2018, 51 (Suppl. S1), e65–e72.
- Bartols A, Bormann C, Werner L, Schienle M, Walther W, Dörfer CE. 2020. A retrospective assessment of different endodontic treatment protocols. PeerJ 8:e8495 ; 2020. http://doi.org/10.7717/peerj.8495.
- Baudot F. La microchirurgie parodontale d’assainissement une nouvelle approche avec le laser erbium-Yag. Le Fil Dentaire n°90 ; 2014 : 14-19.
- Bensoussan D. Apport du laser erbium-Yag en endodontie chirurgicale. Le Fil Dentaire n°90 ; 2014 : 26-20.
- Bergmans L, J Van Cleynenbreugel, M Wevers, P Lambrechts. A methodology for quantitative evaluation of root canal instrumentation using microcomputed tomography. Int Endod J. 2001 Jul;34(5):390-8.doi: 10.1046/j.1365-2591.2001.00413.x.
- Blanken J, De Moor RJG, Meire M, Verdaasdonk R. Laser induced explosive vapor and cavitation resulting in effective irrigation of the root canal. Part 1: a visualization study. Lasers Surg Med. 2009;41(7):514–9.
- Bodurtha Jr., Frank T. & Bonifaz, Cristobal, « Laboratory barricade », issued October 2, 1984.
- Boutsioukis, C.; Arias-Moliz, M.T. Present Status and Future Directions—Irrigants and Irrigation Methods. Int. Endod. J. 2022, 55 (Suppl. S3), 588–612.
- Bracco F.V, « Air Shock Parameter and Design Criteria for Rocket Explosions », WR 65-21, N67-39951, 1965.
- Cai Chen, Cheng Wen, Lanxi Guan, Yuting Huang, Qianzhou Jiang. Influence of sodium hypochlorite concentration on cavitation effect and fluid dynamics induced by photon-induced photoacoustic streaming (PIPS): A visualization study. Lasers Med Sci. 2022 Jul;37(5):2537-2544. doi: 10.1007/s10103-022-03535-x.
- Cîmpean, S.I.; Pop-Ciutrila, I.-S.; Matei, S.-R.; Colosi, I.A.; Costache, C.; Nicula, G.Z.; Badea, I.C.; Colceriu Burtea, L. Effectiveness of Different Final Irrigation Procedures on Enterococcus faecalis Infected Root Canals: An In Vitro Evaluation. Materials 2022, 15, 6688.
- Cobb Charles M. Lasers in Periodontics: A Review of the Literature. Volume77, Issue4 April 2006 ; Pages 545-564. https://doi.org/10.1902/jop.2006.050417
- Cochet JY, Guex D. L’activation des solutions d’irrigation – Endodontie : l’économie tissulaire du laser. Dentoscope 2016 ; 153 : 10-20.
- Cochet JY, Romain Gabriel. Le laser Er:YAG en endodontie. Réalités Cliniques n°1 – 15 mars 2019 (page 21-30).
- Cochet JY, Gabriel R. Comment améliorer le traitement endodontique lors des lésions endo-parodontales ? L’Information Dentaire n° 21 – 29 mai 2024 : 48-58.
- E. Cotti & G. Mercuro. Apical periodontitis and cardiovascular diseases: previous findings and ongoing research. International Endodontic Journal, 48, 926–932, 2015.
- Chen, Y.; Chen, X.L.; Zou, X.L.; Chen, S.Z.; Zou, J.; Wang, Y. Efficacy of Low-Level Laser Therapy in Pain Management after Root Canal Treatment or Retreatment: A Systematic Review. Lasers Med. Sci. 2019, 34, 1305–1316.
- Datey Ahshay. S. Adeeb ThahaC. S. Adeeb Thaha, Sudhir R. PatilSudhir R. Patil Jagadeesh Gopalan,Jagadeesh Gopalan, Dipshikha Chakravortty, Dipshikha Chakravortty. Shockwave Therapy Efficiently Cures Multispecies Chronic Periodontitis in a Humanized Rat Model. Original research article. Front. Bioeng. Biotechnol, Sec. Biomechanics Volume 7 – 2019. https://doi.org/10.3389/fbioe.2019.00382.
- Dragidella Agime, Ariana Kameri. Comparative Effects of Er:YAG Laser, Sodium Hypochlorite, and QMix on Root Canals Infected With Enterococcus faecalisand Candida albicans. J Lasers Med Sci 2023;14:e43.
- Fleming Chris A, DMD, Mark S. Litaker, PhD, Larry W. Alley, DMD,Paul D. Eleazer, DDS, MS. Comparison of Classic Endodontic Techniques versus Contemporary Techniques on Endodontic Treatment Success. Clinical research. JOE — Volume 36, Number 3, March 2010.
- Flotte Thomas J, Apostolos Doukas. Laser-induced pressure effects. SPIE laser tissue interaction 1992 ; 1646 :295-300. 10.1117/12.137489.
- Gnanadhas, D. P. et al. Successful treatment of biofilm infections using shock waves combined with antibiotic therapy. Sci. Rep. 5, 17440; doi: 10.1038/srep17440 (2015).
- Guex D. Quel est l’intérêt du laser en endodontie ? Dentoscope 101 : 29 sept. 2012.
- Guex D. Traitement d’un granulome apical sur un implant par laser Erbium-YAG. Laser vol 3.Issue1 ; 2013 : 6-10.
- Guex D. Irrigation en endodontie, et si nous parlions d’activation ? Le Fil Dentaire n°90 ; 2014 : 20-23.
- Guex D, Rochas O. Les manifestations à distance dans le corps humain des pathologies d’origine endodontique. Dentoscope 2021 ; 231 : 16-24.
- Guex D, Rochas O. Pathologies solutionnées par l’endodontie, Dentoscope 2021 ; 232 : 16-27.
- Gordon Wanda , Vahid A Atabakhsh, Fernando Meza, Aaron Doms, Roni Nissan, Ioana Rizoiu, Roy H Stevens. The antimicrobial efficacy of the erbium, chromium:yttrium-scandium-gallium-garnet laser with radial emitting tips on root canal dentin walls infected with Enterococcus faecalis. J Am Dent Assoc. 2007 Jul;138(7):992-1002. doi: 10.14219/jada.archive.2007.0297.
- Haapasalo Markus. Can We Eliminate Microorganisms From the Root Canal System?, Journal of the California Dental Association, 2018 ; 46:4, 227-235, DOI:10.1080/19424396.2018.12222012.
- Jang Heesuk, Hajun Song, Hae Seog Koh, Taehyun Yoon, Yong Joon Kwon. Ground Technology Research Institute, Agency for Defense Development, Yuseong-gu, Daejeon 34186, Republic of Korea. Shock wave generation in water by nanosecond pulse laser irradiation with 1064 and 2940 nm wavelengths. Optics & Laser Technology Volume 167, December 2023, 109670.
- IDIKO. J. MARTON. How does the periapical inflammatory process compromise general health? Endodontic Topics 2004, 8, 3–14.
- Ith M, H Pratisto, HJ Altermatt, M Frenz, HP Weber. Dynamics of laser-induced channel formation in water and influence of pulse duration on the ablation of biotissue under water with pulsed erbium-laser radiation. Applied Physics B, 1994.
- Karl. R. Zipf, Jr., Ph.D., P.E. Kenneth L. Cashdollar. Effects of blast pressure on the human body » (https://www.cdc.gov/niosh/docket/archive/pdfs/niosh-125/125-explosionsandrefugechambers.pdf). https://en.wikipedia.org/wiki/Overpressure.
- Kornman KS, R C Page, M S Tonetti. The host response to the microbial challenge in periodontitis: assembling the players. Periodontol 2000. 1997 Jun:14:33-53. doi: 10.1111/j.1600-0757.1997.tb00191.x.
- Leconte C. Laser erbium-Yag et parodontologie limite : renoncer aux septums ? ? Le Fil Dentaire n°90 ; 2014 : 36-38.
- Lemos SS, Cesar DE, Procópio SW, Machado FC, Ribeiro LC, Ribeiro RA. Qualitative and quantitative molecular analysis of bacteria in root canals of primary teeth with pulp necrosis.Braz. Oral Res. 2020;34:e.
- Liu, C.; Li, Q.; Yue, L.; Zou, X. Evaluation of Sonic, Ultrasonic, and Laser Irrigation Activation Systems to Eliminate Bacteria from the Dentinal Tubules of the Root Canal System. J. Appl. Oral Sci. 2022, 30, e20220199.
- LukačN, Jezeršek M. Amplification of pressure waves in laser-assistedendodontics with synchronized delivery of Er:YAG laser pulses. Lasers Med Sci. 2018;1:1-12.
- Luks S. Pratical Endodontics Philadelphie : JB Lippincott, 1974 : 82-85.
- Macedo, R.G., Wesselink, P.R., Zaccheo, F., Fanali, D. & Van Der Sluis, L.W. (2010) Reaction rate of NaOCl in contact with bovine dentine: effect of activation, exposure time, concentration and pH. International Endodontic Journal, 43, 1108–1115.
- Marsh, P. D. (2004). Dental plaque as a microbial biofilm. Caries Res. 38, 204–211. doi: 10.1159/000077756.
- Meire Maarten, Roeland J. G. De Moor. Principle and antimicrobial efficacy of laser-activated irrigation: A narrative review. Int Endod J. 2024;57:841–860. DOI: 10.1111/iej.14042
- Mirghani Ruba, Tania Saba, Hebba Khaliq, Jennifer Mitchell, Lan Do, Liz Chambi, Kelly Diaz, Taylor Kennedy, Katia Alkassab, Thuhue Huynh, Mohamed Elmi, Jennifer Martinez, Suad Sawan, and Girdhari Rijal. Biofilms: Formation, drug resistance and alternatives to conventional approaches. AIMS Microbiol. 2022; 8(3): 239–277.
- Mongeot M. Laser et péri-implantites. ? Le Fil Dentaire n°90 ; 2014 : 32-35.
- Nagahashi, T.; Yahata, Y.; Handa, K.; Nakano, M.; Suzuki, S.; Kakiuchi, Y.; Tanaka, T.; Kanehira, M.; Suresh Venkataiah, V.; Saito, M. Er:YAG Laser-Induced Cavitation Can Activate Irrigation for the Removal of Intraradicular Biofilm. Sci. Rep. 2022, 12, 4897.
- Niazi SA, Bakhsh A. Association between Endodontic Infection, Its Treatment and Systemic Health: A Narrative Revie.. Medicina (Kaunas). 2022 Jul 14;58(7):931. doi: 10.3390/medicina58070931.
- Peters O A , K Schönenberger, A Laib. Effects of four Ni-Ti preparation techniques on root canal geometry assessed by micro computed tomography. Int Endod J. 2001 Apr;34(3):221-30. doi: 10.1046/j.1365-2591.2001.00373.x.
- Petricevic Gabrijela Kapetanovic , Marko Katic , Valentina Brzovic Rajic , Ivica Anic and Ivona Bago. The Efficacy of Er:YAG Laser-Activated Shock Wave-Enhanced Emission Photoacoustic Streaming Compared to Ultrasonically Activated Irrigation and Needle Irrigation in the Removal of Bioceramic Filling Remnants from Oval Root Canals—An Ex Vivo Study. Bioengineering (Basel). 2022 Dec; 9(12): 820. doi: 10.3390/bioengineering9120820.
- Restrepo-Restrepo F.A, S. J. Cañas-Jiménez, R. D. Romero-Albarracín, P. A. Villa-Machado, M. I. Pérez-Cano, S. I. Tobón-Arroyave. Prognosis of root canal treatment in teeth with preoperative apical periodontitis: a study with cone-beam computed tomography and digital periapical radiography. International endodontic Journal. Volume 52, Issue11 November 2019, Pages 1533-1546
- Robberecht Lieven, Jérôme Delattre, Maarten Meire. Isthmus morphology influences debridement efficacy of activated irrigation: A laboratory study involving biofilm mimicking hydrogel removal and high- speed imaging. Int Endod J. 2023;56:118–127. DOI: 10.1111/iej.13836.
- Sebbane Nathanyel, Doron Steinberg, David Keinan, Ronit Vogt Sionov, Adi Farber and Sharonit Sahar-Helft. Antibacterial Effect of Er:YAG Laser Irradiation Applied by a New Side-Firing Spiral Tip on nterococcus faecalis Biofilm in the Tooth Root Canal—An Ex Vivo Study. Appl. Sci. 2022, 12, 12656. https://doi.org/10.3390/app122412656.
- Senia E S, F J Marshall, S Rosen. The solvent action of sodium hypochlorite on pulp tissue of extracted teeth. Oral Surg Oral Med Oral Pathol. 1971 Jan;31(1):96-103. doi: 10.1016/0030-4220(71)90040-5.
- Siqueira José F, Isabela N. Rôças. Present status and future directions: Microbiology of endodontic infections. International Endodontic Journal. 2022;55(Suppl. 3):512–530.
- Sharonit Sahar-Helft , Nathanyel Sebbane , Adi Farber, Ronit Vogt Sionov, Roni Dakar and Doron Steinberg. Temperature Changes during Er:YAG Laser Activation with theSide-Firing Spiral Endo Tip in Root Canal Treatment. Photonics 2023, 10(5), 488.
- Sharonit Sahar-Helft, DMD,1 Aysxe Sena Kabasx Sarp, PhD,2 Adam Stabholtz, DMD1, Vitaly Gutkin, PhD,3 Idan Redenski, BSc,1,4 and Doron Steinberg, PhD4. Comparison of Positive-Pressure, Passive Ultrasonic, and Laser-Activated Irrigations on Smear-Layer Removal from the Root Canal Surface. Photomedicine and Laser Surgery Volume 33, Number 3, 2015.
- Segura-Egea JJ, Martín-González J, Castellanos-Cosano L. Endodontic medicine: connections between apical periodontitis and systemic diseases. Int Endod J. 2015 Oct;48(10):933-51
- Song WD, Hong MH, Lukyanchuk B, Chong TC. Laser-induced cavitation bubbles for cleaning of solid surfaces. J Appl Phys 2004;95:2952–6.
- Shouta Sato, Satoshi Takesono, Go Imada. Inactivation of Bacteria in Water by Pulsed Power InjectionIEEJ Volume15, Issue9, 2020. https://doi.org/10.1002/tee.23207.
- Svensäter Gunnel, Gunnar Bergenholtz. Biofilms in endodontic infections. Endodntic Topic. 2004 ; 9 : 27-36.https://doi.org/10.1111/j.1601-1546.2004.00112.x
- Swimberghe, R.C.D.; Tzourmanas, R.; De Moor, R.J.G.; Braeckmans, K.; Coenye, T.; Meire, M.A. Explaining the Working. Mechanism of Laser-Activated Irrigation and Its Action on Microbial Biofilms: A High-Speed Imaging Study. Int. Endod. J. 2022, 55, 1372–1384.
- Tay Franklin R, Li-Sha Gu, G John Schoeffel, Courtney Wimmer, Lisiane Susin, Kai Zhang, Senthil N Arun, Jongryul Kim, Stephen W Looney, David H Pashley. Effect of vapor lock on root canal debridement by using a side-vented needle for positive-pressure irrigant delivery. J Endod. 2010 Apr;36(4):745-50. doi: 10.1016/j.joen.2009.11.022. Epub 2010 Feb 6.
- Tiwari Sanjay Kumar, Suping Wang, Yannan Huang, Xuedong Zhou, Hockin H K Xu, Biao Ren, Xian Peng, Yan Xiao, Mingyun Li, Lei Cheng. Starvation Survival and Biofilm Formation under Subminimum Inhibitory Concentration of QAMs. Biomed Res Int. 2021 Jan 14;2021:8461245. doi: 10.1155/2021/8461245.
- Van Nieuwenhuysen, J.P.; D’Hoore, W.; Leprince, J.G. What Ultimately Matters in Root Canal Treatment Success and Tooth Preservation: A 25-Year Cohort Study. Int. Endod. J. 2023.
- Wen, C.; Yan, L.; Kong, Y.; Zhao, J.; Li, Y.; Jiang, Q. The Antibacterial Efficacy of Photon-Initiated Photoacoustic Streaming in Root Canals with Different Diameters or Tapers. BMC Oral Health 2021, 21, 542.
- Willis M.J, T.J. Ahrens , L.E. Bertani, C.Z. Nash . Bugbuster—survivability of living bacteria upon shock compression. Earth and Planetary Science Letters Volume 247, Issues 3–4, 30 July 2006, Pages 185-196.
- Yang Ruiqi, Yuqing Han, Zhaohui Liu, Zhezhen Xu, Hongyan Liu and Xi Wei. Comparison of the efcacy of laser-activated and ultrasonic-activated techniques for the removal of tricalcium silicate-based sealers and gutta-percha in root canal retreatment: a microtomography and scanning electron microscopy study. BMC Oral Health (2021) 21:275. https://doi.org/10.1186/s12903-021-01638-5.
- Yıldız ganay, E.; Dinçer, B.; Fidan, M.E. Effect of Different Laser-Assisted Irrigation Activation Techniques on Apical Debris Extrusion. Acta Odontol. Scand. 2020, 78, 332–336.
- Zehnder M. Root canal irrigants. JOE. 2006 ; 32 : 389-398.
- Zhuang, H.; Liang, Y.; Xiang, S.; Li, H.; Dai, X.; Zhao, W. Dentinal Tubule Occlusion Using Er:YAG Laser: An In Vitro Study. J. Appl. Oral Sci. 2021, 29, e20200266.