Dr David Guex
Mars 2015 - Le Fil Dentaire
Téléchargez le PDF
Il n’y a rien de plus frustrant en endodontie que d’avoir respecté à la lettre l’ensemble des protocoles de nettoyage et de désinfection, et d’avoir finalement une dent qui ne réagit pas à notre traitement. Une dent asymptomatique devient douloureuse, ou bien la pathologie ne disparaît pas, etc. Pourquoi, qu’en est-il, qu’est-ce qui n’a pas fonctionné ?
Ce sont les articles scientifiques qui vont nous aider à comprendre
Tout d’abord, nous devons prendre en compte la complexité de l’anatomie endocanalaire. Celle-ci a été décrite par le Docteur Walter Hess, les fameuses planches de Hess[1]. Ses dessins réalisés à l’encre de chine en 1917 montrent toute la complexité de l’endodonte : des isthmes, des anses, des canaux latéraux… En voyant ses dessins, chaque Chirurgien-Dentiste comprend l’intérêt de garder les dents vivantes, mais parfois, cela n’est pas possible.
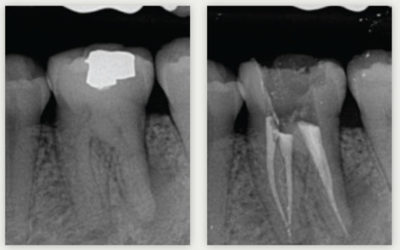
Lorsque nous devons réaliser une biopulpectomie ou un retraitement, le microscope opératoire nous procure une aide appréciable. Nous travaillons le dos droit, nous voyons nos entrées canalaires parce-qu’ elles sont éclairées par la lumière du microscope et parce-que son optique nous grossit ces mêmes entrées. Des entrées canalaires non visibles à l’œil humain deviennent accessibles à nos instruments. L’exemple le plus parlant est la recherche de ce fameux « quatrième canal » de la première molaire maxillaire. Ce quatrième canal est présent dans quasiment 100% des cas.
En corrélation avec les planches de Hess, nous pouvons relier l’article de Peters[2] : « sur les molaires maxillaires, quelque-soit la technique utilisée, plus de 35% des surfaces canalaires demeurent non instrumentées. » C’est énorme.
Mais ce que nous devons intégrer en définitif sur l’anatomie, ce ne sont pas seulement les canaux et leurs ramifications, mais surtout le regard que porte la Microscopie Electronique à Balayage sur les parois canalaires : les tubuli dentinaires. Leur nombre est gigantesque. Les tubuli dentinaires ont un espace suffisant pour accueillir les bactéries[3]. Le défi anatomique devient alors majeur.
Mais qu’en est-il lorsque cette anatomie est contaminée par les bactéries ?
Dans un premier temps, les bactéries progressent par DIVISION plutôt que par déplacement[4]. Ce qui signifie que pour arriver à l’apex, leur nombre doit croître. Et ce que nous trouvons à l’apex, ce sont les bactéries les plus pathogènes[5]. Car bien évidemment, lorsque nous leur laissons du temps, les bactéries vont s’organiser en un biofilm. Un biofilm est constitué en volume d’environ 15% de bactéries et de 85% de matrice[6]. La flore endodontique comprend plus de 500 espèces[7], et ce biofilm devient 1000 à 2000 fois plus résistant aux solutions antiseptiques[7bis]. Par exemple, la concentration nécessaire d’antibiotique pour tuer les souches bactériennes dans un biofilm est 250 fois plus importante que pour des souches bactériennes à croissance planctonique[8].
Ainsi, la conjonction entre l’anatomie endodontique et le degré de contamination bactérienne met en évidence qu’il va nous falloir de l’énergie d’irrigation ET pour déstructurer le biofilm bactérien ET pour faire diffuser nos produits dans les tubuli dentinaire. La solution désinfectante de choix est l’hypochlorite de sodium ayant une concentration située entre 2,5 à 6%. Elle possède un large spectre contre les bactéries, spores, levures, virus[9] et elle permet de dissoudre les tissus grâce à sa capacité d’oxydation et d’hydrolyse des protéines cellulaires[10].
Le premier moyen pour faire diffuser l’hypochlorite de sodium jusque dans le péri-apex est l’instrumentation du canal. Cela nous permet de créer un espace pour véhiculer l’irrigant et de couper la dentine contaminée[11].
Cependant, en instrumentant un canal, nous créons une substance endogène : la smear layer. Elle contient des substances organiques et inorganiques composées des microorganismes et des débris nécrotiques[12]. Cette couche de smear layer peut être tassée à l’intérieur des tubuli dentinaires jusqu’à 40 µm de profondeur[13]. La smear layer peut être infectée et peut protéger les bactéries présentes à l’intérieur des tubuli dentinaires en empêchant une action efficace d’agents désinfectants intracanalaires[14]-[15].
Par conséquence, nous devons employer de l’EDTA à 17% afin de dissoudre la partie minérale grâce à son action chélatante[16].
Déjà en 1943, Grossman a défini un cahier des charges sur les principes généraux de l’irrigation en endodontie[17]. Pour une irrigation efficace, les solutions utilisées doivent permettre un « lavage » canalaire par une action antiseptique, éliminer les micro-organismes, éliminer les copeaux dentinaires, permettre une lubrification des instruments endodontiques, être non agressive pour le péri-apex.
Mais toutes les études montrent clairement qu’il n’est pas possible de stériliser un réseau canalaire infecté car la région apicale représente la limite d’efficacité de l’irrigation[18]-[19]. O’Connel et al. en 2004 (cité par Gu) montrent que l’irrigation n’est efficace que dans les 2 premiers tiers coronaires du canal. Et deux études montrent que, même si on amène une aiguille à LT-1, il reste de la smear layer au niveau apical[20]. Ainsi, nous comprenons que malgré nos efforts pour irriguer un canal, les irrigants ne peuvent pas toujours aller à l’apex. La raison est simple : la présence de la colonne d’air dans le canal[21]. Cette colonne d’air empêche l’irrigant d’aller plus loin que le bout de l’aiguille d’irrigation[22].
Ainsi, pour augmenter l’efficacité des solutions d’irrigation et leur surface d’action, il est préconisé une activation de ces solutions d’irrigation[23].
La première technique d’activation, l’une des plus efficaces et la moins chère, c’est l’agitation manuelle dynamique. Elle consiste à utiliser un cône de gutta percha ajusté au foramen apical, et d’effectuer des mouvements de va et vient verticaux. Ceux-ci provoquent un effet hydrodynamique qui améliore considérablement le déplacement et donc l’efficacité des solutions d’irrigation[24].
La seconde technique d’activation la plus usitée dans les cabinets dentaires est l’emploi des ultra-sons. Les ultra-sons créent une énergie vibratoire générant des ondes acoustiques entrainant un mouvement des fluides[25]. Mais il est primordial de noter que si la lime rentre en contact avec les parois canalaires ce phénomène de cavitation est annulé, puisque les ondes se perdent dans les parois canalaires[26]. Cependant les études sur les ultra-sons sont contradictoires. Il en ressort que c’est dans les deux premiers tiers radiculaires que les ultra-sons sont efficaces[27].
Alors, comment dépasser les limites de ces méthodes d’activations ? Il faut transmettre aux solutions d’irrigation une énergie qui favorise son agitation globale en se diffusant dans les irrigants avec le moins de contraintes possibles.
En pensant ENERGIE, nous pouvons penser aux lasers. Un laser a la particularité d’émettre une onde lumineuse intense dont la direction, la fréquence et la phase sont très bien déterminées. Il s’agit d’une lumière dite cohérente, contrairement par exemple à celle émise par une ampoule à filament, qui émet de nombreuses ondes de fréquences et phases diverses et ce dans toutes les directions.
Hirono Takeda en 1998 a montré qu’en endodontie, le laser le plus efficace est le laser Erbium:Yag pour l’élimination des débris et de la smear layer[28]. Car cette colonne d’air qui nous empêche de faire diffuser les irrigants va devenir un atout pour le laser Erbium:YAG. L’activation du laser erbium dans un environnement aqueux génère de larges bulles qui grossissent puis explosent. Cette expansion cause une haute pression dans les fluides[29].
L’emploi du laser Erbium:YAG sur l’hypochlorite de sodium à 5,25 % montre une réduction bactérienne proche de 100% sur des dents contaminées à Enterococcus faecalis[30], que ce soit sur les parois canalaires ou dans les tubulis sur une profondeur de 100 à 200 µm[30bis].
De plus, quelque soit la technique utilisée (seringue d’irrigation, ultra-sons), l’utilisation de l’erbium:YAG augmente de façon significative le nettoyage de la dentine infectée par un biofilm[31]. Lorsque nous regardons sous microscope un tips laser Er:YAG, en position statique, situé à 2 ou 3 mm de l’entrée du canal mésio lingual du première molaire mandibulaire, dès que nous activons les solutions d’irrigation, il est fréquent d’observer des débris ressortir du canal mésio vestibulaire ; alors même que les deux canaux sont anatomiquement indépendants. Nous pouvons en déduire que l’énergie diffusée dans les liquides est si poussée que les débris ont été chassés de l’isthme reliant le canal mésio lingual et mésio vestibulaire.
Il nous reste un moyen simple pour vérifier la véracité de cette bibliographie : réaliser des tests sur des blocs en résine, sur des répliques de dents en résines (True Tooth) ou sur des dents naturelles rendues transparentes selon la méthode d’Augusto Malentacca. Mais quelque soit le modèle utilisé, il sera important que les apex soient scellés par de la colle ou de la résine afin de recréer les conditions d’étanchéité du péri-apex.
En conclusion, dans notre activité d’endodontie, l’association du microscope opératoire et du laser Erbium:YAG représente un plus technologique qui peut nous aider à être plus performant dans notre exercice.
Remerciements
Je tiens à remercier le Docteur Jean-François Sevain, pour son aide précieuse et minutieuse à la correction de cet article, et de tous les précédents.
Cet article est le résumé de ma conférence donnée à l’ADF 2014, je tenais à remercier l’aide professionnelle et amicale apportées par le Docteur Jean Yves Cochet. Le premier Endodontiste Français a avoir publié sur les effets apportés par la technologie laser est le Docteur D. Bensoussan.
Omnipraticien à Villié-Morgon depuis 1999.
Endodontiste exclusif à Bron depuis 2009.
Diplôme universitaire d’anatomie et dissection crânio-cervico-facial de la faculté de médecine de Paris.
Bibliographie
1 The anatomy of the root-canals of the teeth of the permanent dentition, by Walter Hess and the anatomy of the root-canals of the teeth of the deciduous dentition, and of the first permanent molars, by Ernst Zürcher. New York, Wm. Wood & co., 1925.
2 Peters OA, Schönenberger K, Laib A. Effects of four Ni-Ti preparation techniques on root canal geometry assessed by micro computed tomography. Int Endod J 2001 ; 34 : 221-230.
3 Perez F, Calas P, De Falguerolles A, MauretteA, Migration of a Streptococcus sanguis strain through the root dentinal tubules. J Endod 1993 a ; 76 : 97-103.
4 Hall-Stoodley L, Stoodley P. Biofilm formation and dispersal and the transmission of human pathogens, Trend Microbiol 2005 ; 13 : 7-1.
5 Molven O, Olsen I, Kerekes K. Scanning electron microscopy of bacteria in apical part of root canals in permanent teeth with periapical lesions, Endod Dent Traumatol 1991 ; 7 : 226-229.
6 Costertoon W, Veeh R, Shirtliff M, Pasmore M, Post C, Ehrlich G. The application of biofilm science to the study and control of chronic bacterial infections. J Clin Invest 2003 ; 112 : 1466-1477.
7/7bis Svensater G, Bergenholtz G. Biofilms in endodontic infections. Endod Topics.2004 ; 9 : 27-36.
8 Sedlacek MJ, Walker C. Antibiotic resistance in an in vitro subgingival biofilm model. Oral Microbiol Immunol 2007 ; 22 : 333-339.
9 Mc Donnell G, Russel AD. Antiseptic and desinfectants : activity, action and resistance. Clin Microbiol Rev 1999 ; 12: 147-179.
10 Pashley EL, Birdsong NL, Bowman K, Pashley DH. Cytotoxic effects of a NaOCl on vital tissue. J Endod 1985 ; 11 : 525-528.
11 Peters OA. Current challenges and concepts in the preparation of root canal systems : a review. J Endod 30 : 559, 2004.
12 TORABINEJAD M, HANDYSIDES R, KHADEMI A.A., BAKLAND L.K. Clinical implications of the smear layer in endodontics : a review. Oral Surg 2002;94:658-666.
13 MADER C.L., BAUMGARTNER J.C., PETERS D.D. Scanning electron microscopic investigation of the
smeared layer on root canal walls. J Endod 1984;10:477-483.
14 Zehnder M. Root canal irrigants. JOE. 2006 ; 32 : 389-398.
15 HAAPASALO M., ORSTAVIK D. In vitro infection and disinfection of dentinal tubules. J dent Res 1986;66:1375-1379.
16 Shahravan A, Haghdoost AA, Adl A, Rahimi H, Shadifar F . Effects of smear layer on sealingability of a canal obturation : a systematic review of a meta-analysis. J Endod 2007 ; 33 : 96-105.
17 Grossman LI, Meiman BW. Solution of pulp tissue by chemical agents. J Am Dent Assoc. 1941 ; 28 : 223-225.
18 Simon S,Machtou P, Pertot W, Endodontie, édition CdP 2012, collection JPIO, chapitre 11, p 227.
19 Senia ES, Marschall JF, Rosen S. The solvent action of sodium hypochlorite on pulpe tissue of extracted teeth. Oral Surg Oral Med Oral Pathol 1971 ; 31 : 96-103.
20 O’Connell MS, Morgan LA, Beeler WJ, Baumgartner JC. A comparative study of smear layer removal using different salts of EDTA. J Endod 2000;26:739–43.
21 Luks S. Practical endodontics. Philadelphie : JB Lippincott, 1974 : 82-85.
22 Bronnec F, Bouillaguet S, Machtou P, Ex vivo assessment of irrigant penetration and renewal during the cleaning and shaping of root canals : a digital subtraction radiographic study, Int Endod J 2010a ; 43 : 275-282.
23 Zehnder M. Root canal irrigants. JOE. 2006 ; 32 : 389-398.
24 Caron G. Cleaning efficiency of the apical millimeters of curved canals using three different modalities of irrigant activation: an SEM study. Paris VII University, Paris, France: Masters thesis ; 2007.
25 Schäfer E. Irrigation of the root canal. Endo. 2007 ; 1 : 11-27.
26 Van der Sluis L, Versluis M., Wu M, Wesselink P. Passive ultrasonic irrigation of the root canal: a review of the literature. IEJ. 2007 ; 40, 415–426. 415.
27 Mayer BE, Peters OA, Barbakov F,. Effects of rotary instruments and ultrasonic irrigation on debris and smear layer scores : a scanning electron microscopic study . Int Endod J ; 35 : 582, 2002.
28 Takeda FH, Harashima T, Kimura Y, Matsumoto K. Comparative study about the removal of smear layer by three types of laser devices. J of Clinical Laser. 1998 ; 16 : 117-122.
29 Blanken et al (2007) Cavitation as working mechanism of the Er,Cr:YSGG laser in endodontics : a visualization study. Journal of Oral Laser Applications ; 7 : 97-106.
30/30bis Xiaogang Cheng et al. Evaluation of the Bactericidal Effect of Nd:YAG, Er:YAG, Er,Cr:YSGG Laser Radiation, and Antimicrobial Photodynamic Therapy (aPDT) in Experimentally Infected Root Canals.. Lasers in Surgery and Medicine 44:824–831 (2012).
31 Ordinola-Zapata and al. Biofilm removal by 6 % sodium hypochlorite activated by different irrigation techniques. Int Endod J ; nov 2013.