Dr David Guex
Février 2014 - Le Fil Dentaire n°90
Téléchargez le PDF
L’un des défis de l’endodontie est d’obtenir une destruction aussi complète que possible de la charge bactérienne. L’un des moyens utilisé est l’irrigation, qu’on a tenté d’activer par différentes techniques. Aujourd’hui, la miniaturisation des embouts et la maniabilité de la pièce à main du laser Erbium:YAG permettent l’accès canalaire malgré les angles morts.
Le biofilm bactérien
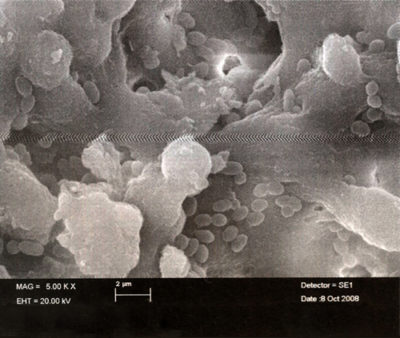
La pénétration des bactéries dans l’endodonte signe le début des problèmes.
- Au départ, la contamination est le fait de bactéries planctoniques [1]-[2] qui sont assez faciles à détruire (Fig. 1), mais elles s’organisent rapidement en un biofilm (Fig 2).
- Au sein du biofilm, une compétition s’organise entre les bactéries pour finalement retrouver les aérobies en surface, comme agent de protection des anaérobies situées à l’intérieur.
En conséquence, il faut 250 fois plus d’antibiotiques pour détruire les bactéries du biofilm que les bactéries planctoniques. D’autre part, les bactéries migrent dans l’endodonte non pas par déplacement mais par multiplication (Fig. 3) [3]-[4]. Ce qui signifie que la quantité bactérienne augmente de façon exponentielle en fonction du temps.
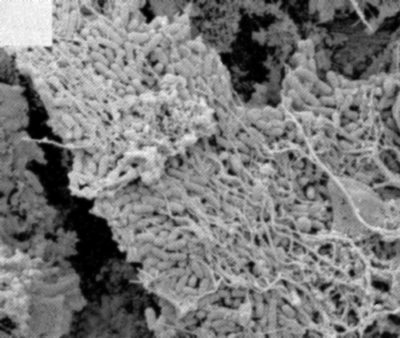
Il semble que chaque dent possède un modèle unique d’infection bactérienne dans lequel la présence d’un biofilm bactérien est la règle.
Les bactéries de la flore endodontique colonisent la totalité du réseau canalaire radiculaire. On les retrouve donc :
- sur les restes de tissu pulpaire nécrosé où elles trouvent les éléments nutritifs nécessaires à leur croissance
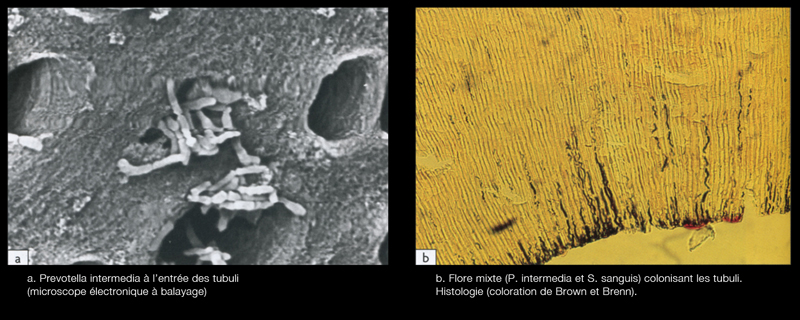
- le long des parois canalaires, où elles adhèrent les unes aux autres sur plusieurs couches, s’organisant en biofilm (Fig. 5)
- dans les canaux accessoires et les delta apicaux
- à l’intérieur des tubuli dentinaires sur une profondeur de plusieurs centaines de microns, les bactéries se logent préférentiellement dans le premier tiers de la dentine péricanalaire (Fig. 6)[5]

Il est cependant illusoire de vouloir aboutir à une « stérilisation » du canal infecté Une élimination totale des bactéries n’est pas envisageable mais nos manœuvres thérapeutiques doivent tendre vers une réduction significative de la charge bactérienne canalaire pour permettre d’atteindre un « taux critique » acceptable et garant du succès du traitement endodontique[6].
L’anatomie endo-canalaire
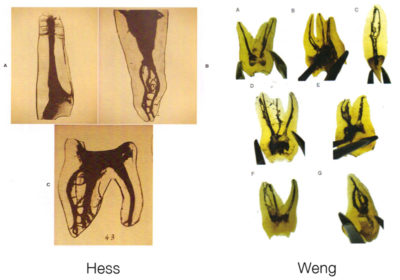
Les travaux de Weng en 2009, ne font que confirmer ce que Hess avait sous ses yeux en 1917, à savoir que l’anatomie pulpaire est infiniment plus compliquée qu’un simple canal dans sa racine (Fig. 7). Il s’agit plus de méandres, d’anastomoses et de labyrinthes.
Les moyens de désinfection chimique
Ils sont au nombre de deux :
L’hypochlorite de sodium (concentrée à 5 - 6 %) : elle possède un large spectre antibactérien (bactéries, spores, levures, virus). Cette action est due à sa capacité d’oxydation et d’hydrolyse des protéines cellulaires. Son hypertonicité permet, par diffusion, l’évacuation des fluides cellulaires. La solution doit arriver au contact des tissus[7].
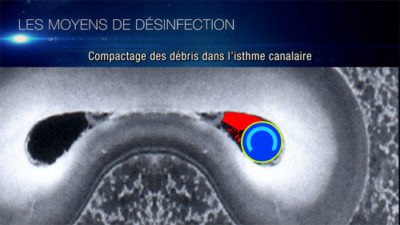
Craig Barrington montre la contamination de cet isthme (Fig. 8), nous comprenons l’importance de la diffusion de la solution d’irrigation afin d’éliminer le biofilm bactérien au-delà des canaux principaux.
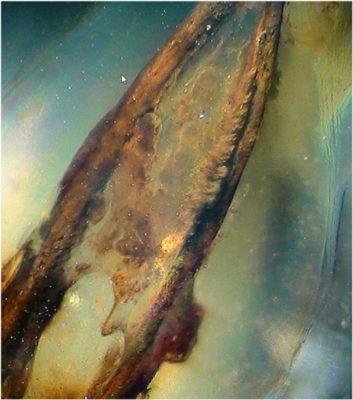
L’EDTA à 17% : ce liquide permet l’élimination des boues dentinaires. Les manœuvres instrumentales effectuées lors de la mise en forme canalaire créent, en milieu humide, une pellicule de boue dentinaire de 1 à 5 μm d’épaisseur, composée d’un agrégat de débris organiques et minéraux (Fig. 9). Son élimination permet un parrage canalaire complet ainsi que l’étanchéité de son obturation[8].
Les moyens de désinfection mécanique
L’alésage : son but est d’emmener l’irrigant à l’apex et d’éliminer la dentine contaminée.
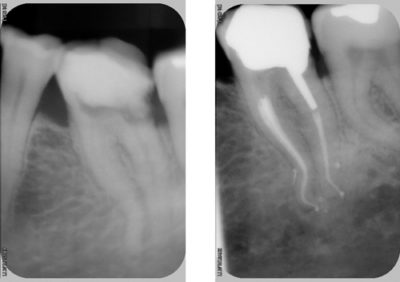
Cependant, sur les molaires maxillaires, quelle que soit la technique rotative utilisée, plus de 35 % des surfaces canalaires demeurent non instrumentées[9]-[10].
La seringue d’irrigation
L’ensemble des études récentes conclut que le tiers apical représente la limite d’efficacité de l’irrigation[11] . Pourtant, sur les dents infectées, c’est dans les derniers mm apicaux que ce situent les bactéries nocives[12].
La solution d’irrigation délivrée à la seringue, sans coincer l’aiguille dans le canal, ne va pas plus loin que le bout de l’aiguille en raison de la présence d’une colonne d’air[13] dont étonnement, on redécouvre l’importance aujourd’hui[14] (Fig. 11).
Fig. 11 : Bulle d'air apicale
La pénétration et l’échange de la solution sont améliorés avec la progression de la mise en forme.
L’irrigation n’est réellement efficace qu’à la fin de la mise en forme canalaire. L’espace de reflux situé entre l’aiguille de la seringue et les parois canalaires permet la création d’un circuit hydraulique qui autorise un échange progressif de la solution.
Les ultrasons
L’effet majeur des US est surtout l’élévation de température générée sur l’hypochlorite qui augmente son pouvoir antibactérien. Par contre, son effet de diffusion dans les différentes zones de l’endodonte est plus restreint, d’autant plus que si les US touchent les parois canalaires, cela recrée une couche de smear layer, qu’il faudra à nouveau enlever.
Le laser Erbium:YAG
Le fonctionnement
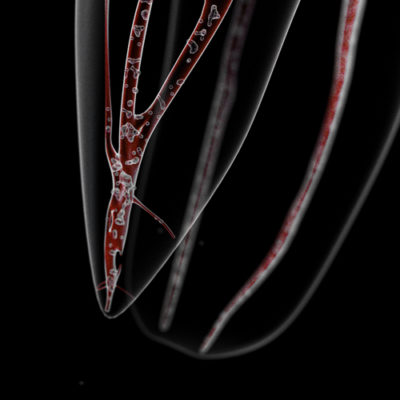
L’ionisation atomique crée un plasma (Fig. 13). Ce plasma crée une augmentation de pression (Fig. 14).
Fig. 13 : Blast (Courtoisie Syneron)
Fig. 14 (Courtoisie Syneron)
Il y a, en même temps, une explosion de la molécule d’eau (Fig. 15).
Fig. 15 (Courtoisie Syneron)
L’augmentation de pression couplée à l’explosion de la molécule d’eau génère une onde de choc appelée BLAST.
Ce blast provoque à la fois un éclatement des membranes bactériennes et une meilleure diffusion des irrigants dans l’endodonte.
L’amplification de l’effet photo-acoustique induit par une fibre laser statique située 2 mm au dessus de l’entrée canalaire améliore l’agitation des solutions d’irrigation, donc augmente leur circulation dans le réseau canalaire (Fig. 12). Il faut tirer dans la solution présente dans la chambre pulpaire.
À partir de la lecture de l’article 1 de la bibliographie, le meilleur moyen de réduire la population bactérienne dans les tubuli dentinaires sur une profondeur de 100 à 200 ym à partir des parois canalaires est l’utilisation de l’Erbium:YAG couplée à l’hypochlorite (Fig. 16).

Toujours à partir de l’article 1, sur des dents contaminées artificiellement avec l’entérocoque faecalis, le laser Erbium:YAG travaillant dans de l’eau distillée élimine cette bactérie sur 99,97 % des parois canalaires. Cela indique que l’agitation provoquée par l’Erbium:YAG est grandement efficace (Fig. 17).

D’autre part, l’étude de Ordinola-zapata et coll[15] montre que sur des dents contaminées artificiellement par 4 types de biofilm bactérien, l’efficacité de l’élimination est significativement augmentée par l’utilisation du laser Erbium:YAG dans de l’hypochlorite de sodium.
L’activation par l’Erbium:YAG de l’hypochlorite de sodium pendant 0,0842 secondes (= 1684 tirs de 50 μs) correspond au fonctionnement combiné Ultra-Sons + Self Adjusting File pendant 2 minutes[16].
Cela signifie que si nous activons au laser Erbium:YAG l’hypochlorite : 12 secondes par canal et si nous activons l’EDTA : 6 secondes par canal, cela fait un total de 18 secondes par canal Donc, pour une molaire constituée de 4 canaux, cela correspond à 72 secondes.
72 secondes d’activation au laser Erbium:YAG correspond à un nettoyage aux US + SAF de cette même molaire de 3h30.
Nous avons réalisé des travaux sur des dents rendues transparentes, elles-mêmes recoulées dans de la résine transparente afin que les apex soient étanches. Notre objectif premier est de recréer le poids de la colonne d’air dans le canal.
Nos constatations sont les suivantes :
- lorsque nous activons des tirs lasers dans un canal NON préparé (exemple : racine distale d’une 16), les autres canaux NON préparés sont eux aussi activés (racine palatine et MV1).
- bien souvent, les canaux accessoires sont nettoyés avant la partie apical.
In vivo, quelque soit le système utilisé pour potentialiser l’irrigant, nous constatons systématiquement une remontée de débris supplémentaires lorsque le laser Erbium:YAG est employé.
L’effet le plus spectaculaire est la remontée d’un gros paquet d’agrégats de smear layer d’un canal alors que le tips laser travaille dans un autre canal.
Conclusion
Le nettoyage canalaire dépend du rapport entre deux facteurs intimement liés : l’anatomie de l’endodonte et les bactéries.
À ce jour, il me semble que le laser Erbium:YAG apporte des solutions nouvelles :
- une remontée plus importante de débris organiques que la seringue d'irrigation

Seringue d'irrigation. (c) Carlos Matias - une remontée plus importante de smear layer que la seringue d'irrigation
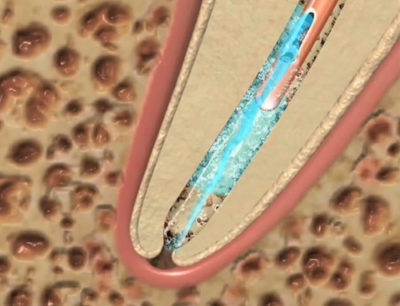
Plus l’endodonte est compliqué, avec isthmes, méandres, anastomoses, plus les bactéries sont inaccessibles. Plus les bactéries disposent de temps et plus elles s’organisent en biofilm : il faudra donc d’autant plus d’énergie pour les détruire.
D’où ce concept de nettoyage canalaire énergie-dépendant que nous proposons.
Omnipraticien à Villié-Morgon depuis 1999.
Endodontiste exclusif à Bron depuis 2009.
Diplôme universitaire d’anatomie et dissection crânio-cervico-facial de la faculté de médecine de Paris.
Bibliographie
1 XIAOGANG CHENG AND AL. Evaluation of the Bactericidal Effect of Nd:YAG,Er:YAG, Er,Cr:YSGG Laser Radiation, and Antimicrobial Photodynamic Therapy (aPDT) in Experimentally Infected Root Canals Lasers in Surgery and Medicine ; 44 : 824–831 (2012)
2 F. PAQUÉ, C. BOESSLER & M. ZEHNDER Accumulated hard tissue debris levels in mesial roots of mandibular molars after sequential irrigation steps Volume 44 number 2 February 2011 page 148- International Journal of Endo
3 PEREZ F, CALAS P, DE FALGUEROLLES A, MAURETTE A. Migration of a Streptococcus sanguis strain though the root dentinal tubules J Endod 1993a ; 19 : 297-301
4 PEREZ F, CALAS P, ROCHD T effect of dentin treatment on in vitro root tubule bacterial invasion Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1996 ; 82 : 446-451
5 PEREZ F Endodontie 2012 CdP, chapitre 7, p 126
6 PEREZ F Endodontie 2012 CdP, chapitre 7, p 131
7 PASHLEY EL, BIRDSONG NL, BOWMAN K, PASHLEY DH. Cytotoxic effects of NaOCL on vital tissue J Endod 1985 ; 11 : 525-528
8 MADER CL, BAUMGARTNER JC, PETERS DD. Scanning electron microscopic investigation of the smeared layer on root canal walls J Endod 1984 ; 10 : 477-483
9 BERGMANS L, VAN CLEYNENBREUGEL J, WEVERS M, LAMBRECHTS P. A methodology for quantitative evaluation of root canal instrumentation using microcomputed tomography Int endod J 2001; 34 : 390-398
10 PETERS OA, BOESSLER C, PAQUÉ F Root canal preparation with a novel nickel-titanium instrument evaluated with micro-computed tomography : cnal surface preparation over time Int endod J 2001 ; 34 : 184-188
11 SENIA ES, MARSHALL JF, ROSEN S. The solvent action of sodium hypochlorite on pulpe tissue of extracted teeth Oral Surg Oral Med Oral Pathol 1971 ; 31 :96-103
12 MOLVEN O, OLSEN I, KEREKES K. Scanning electron microscopy of bacteria in the apical part of roots canal in permanent teeth with periapical lesions Endod Dent Traumatol 1991 ; 7 : 226-229
13 LUKS S. Practical endodontics Philadelphie : JB Lippincott, 1974 : 82-85
14 TAY FR, GU LS, SCHOEFFEL GJ, WIMMER C, SUSIN L, ZHANG K ET AL. Effect of vapor lock on root canal debridement by using a sidevented needle for positivepressure irrigant delivery J endod 2010 ; 36 : 745-750
15 ORDINOLA-ZAPATA ET COLL. Biofilm removal by 6 % sodium hypochlorite activated by different irrigation techniques International Endodontic Journal november 2013
16 SEDLACEK MJ, WALKER C. Antibiotic resistance in an in vitro subgingival biofilm model Oral Microbiol Immunol 2007 ; 22 : 333-339 Liste exhaustive de la bibliographie sur la version digitale de l’article